Kemiallisen reaktion kinetiikka
Kemiallisten reaktioiden nopeudella on suuri merkitys mm. kotitaloudessa, luonnossa ja kemikaaliteollisuudessa. Permanentti onnistuu, ja asiakas saa hiuksiinsa ennalta sovitun värin, kun kampaaja tietää, kuinka kauan ja missä lämpötilassa aineiden on annettava vaikuttaa. Juustoja on säilytettävä kypsyttämössä tietyssä lämpötilassa tietyn aikaa, jotta tuloksena on oikeanmakuista juustoa. Elintarvikepakkauksissa käytetään suojakaasuja, jotta pilaantumista aiheuttavat kemialliset tapahtumat hidastuisivat tai estyisivät kokonaan. Kemiallisen reaktion reaktionopeuden toivotaan toisaalla olevan pieni (ruostumisessa), toisaalla suuri (teollisissa synteeseissä).


Reaktiokinetiikan perustajat
Reaktiokinetiikka tutkii reaktionopeuksia ja reaktioiden mekanismia, eli millaisten prosessien kautta lähtöaineista muodostuu tuotteita riippumatta siitä, onko reaktio ekso- vai endoterminen. Reaktioiden nopeuteen ja tasapainotilan saavuttamiseen voidaan vaikuttaa lämpötilaa muuttamalla, sekoittamisella, hienontamisella, pitoisuutta muuttamalla ja katalyyteillä. Reaktiokineettisissä tarkasteluissa otetaan huomioon myös, tapahtuuko reaktio yhdessä vai useammassa faasissa. Tämän perusteella reaktiot jaetaan homogeenisiin ja heterogeenisiin reaktioihin.
Fysikaalisen kemian tutkijoita hollantilaista Jacobus Henricus van't Hoffia (1852–1911) ja ruotsalaista Svante August Arrheniusta (1859–1927) sekä saksalaista kemistiä Friedrich Wilhelm Ostwaldia (1853–1932) pidetään reaktiokinetiikan perustajina. Hoff julkaisi v. 1884 kirjan Etudes de dynamique chimique, jossa hän esitteli monia fysikaalisen kemian tärkeimpiä periaatteita, kuten reaktionopeuden ja konsentraation sekä tasapainovakion ja reaktionopeusvakion välillä vallitsevia suhteita. Arrhenius puolestaan tutki laajasti reaktionopeuden ja lämpötilan välistä riippuvuutta.
Rakenneosien törmäykset johtavat reaktioihin
Kemiallisen reaktion käynnistyminen voidaan selittää törmäysteorian eli kollisioteorian avulla. Törmäysteorian mukaan vain oikeassa asennossa ja riittävällä nopeudella tapahtuvat hiukkasten törmäykset johtavat kemialliseen reaktioon.
Reaktion nopeus kasvaa törmäysten lukumäärän kasvaessa ja vastaavasti pienenee törmäysten vähentyessä. Olisi kuitenkin liian yksinkertaista olettaa, että jokainen kahden hiukkasen törmäys johtaisi reaktioon. Normaalitilassa kaasussa tapahtuu n. 109 törmäystä sekunnissa. Tällöin jokaisella hiukkasella olisi 109 kertaa sekunnissa mahdollista kohdata toinen molekyyli. Jos kaikki törmäykset johtaisivat reaktioon, reaktionopeus olisi aina tavattoman suuri. Todellisuudessa reaktionopeudet ovat paljon pienemmät, ja suurimmassa osassa törmäyksistä hiukkaset vain kimpoavat muuttumattomina erilleen. Jos näin ei olisi, monet aineista olisivat jo kauan sitten reagoineet muiksi tuotteiksi, ja tuntemamme kaltaista elämää tuskin esiintyisi maapallolla, mikäli maapalloa edes olisi olemassa.
Reaktionopeus
Kemialliset reaktiot tapahtuvat eri nopeuksilla. Neutraloituminen, saostuminen ja jotkin hapettumisreaktiot, kuten räjähdykset, etenevät tavattoman nopeasti. Usein vaikuttaa siltä, että reaktiot tapahtuvat välittömästi aineiden päästessä kosketuksiin toistensa kanssa. Ruoan valmistuksessa toivoisi joskus, että reaktiot tapahtuisivat nopeammin, esim. kasvisten kypsyminen uunissa tai keitinvedessä. Toisaalta elimistöä vanhentavat kemialliset prosessit etenevät hitaasti, vuosien ja vuosikymmenten aikana. Öljyn ja hiilen muodostuminen fossiilisiksi polttoaineiksi vaati miljoonia vuosia. Reaktionopeudella on valtava käytännön merkitys mm. lääketeollisuudessa. Kemiallisen reaktion nopeus voi olla merkittävä tekijä ihmisen henkiinjäämisessä. Rakennusteollisuudessa sementin kuivumisnopeuden väärin arvioiminen voi johtaa valtaviin taloudellisiin ja terveydellisiin menetyksiin.
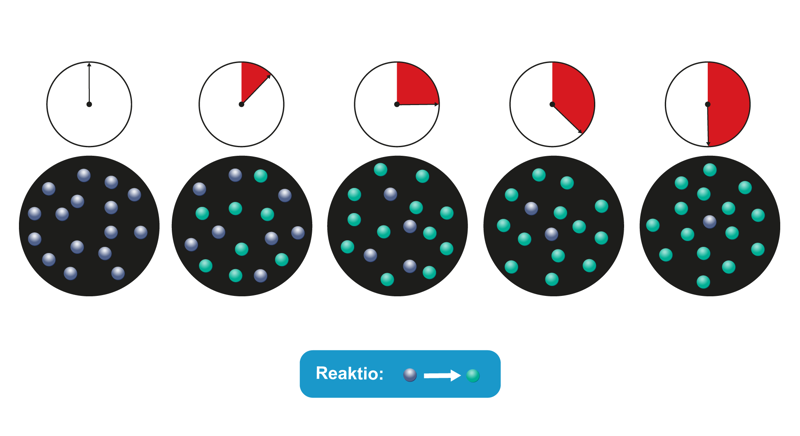
Kuinka paljon jotakin lähtöainetta kuluu tai reaktiotuotetta muodostuu aikayksikössä, määritellään reaktionopeudeksi. Reaktionopeus ilmoitetaan yleensä konsentraation muutoksena tietyssä aikayksikössä. Muita yleisiä esitysmuotoja ovat massan tai tilavuuden muutos aikayksikössä. Aikaa mitataan sekunneissa, minuuteissa tai tunneissa.
Reaktionopeuden lauseke voidaan kirjoittaa muotoon , missä on tutkittavan aineen konsentraatio tarkasteluhetkellä. Kerroin on reaktionopeusvakio, jonka arvoon on sisällytetty ulkoiset tekijät ja aineiden kemiallinen luonne, jotka myös vaikuttavat reaktionopeuteen. Jokaiselle reaktiolle voidaan kokeellisesti määrittää reaktionopeusvakion arvo. Etumerkki on valittu siten, että lähtöaineen konsentraatio pienenee ja tuotteen pitoisuus suurenee reaktion edetessä.
Reaktionopeus
Lähtöaine
Reaktiotuote
Reaktionopeuskuvaaja
Reaktionopeutta voidaan tarkastella reaktionopeuskäyrän avulla. Se muodostetaan mittaamalla konsentraation muutos ajan suhteen ja piirtämällä mittaustuloksien perusteella kuvaaja. Kuvaajan muoto on tyypillisesti alusta loppua kohden loiveneva käyrä, jonka jyrkin kohta on kuvaajan alkupuolella, ja joka asettuu lopussa vaaka-akselin suuntaiseksi.
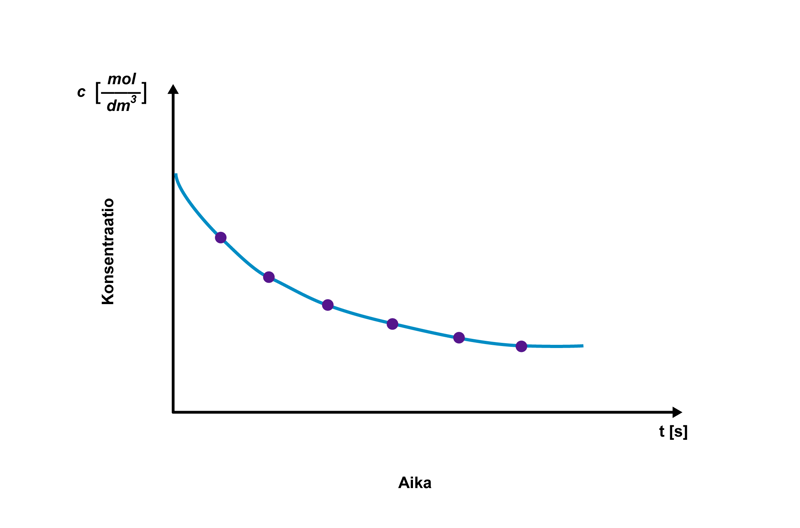
Käyrän loiveneva muoto merkitsee, että reaktionopeus muuttuu reaktion edetessä. Reaktionopeuden muuttuminen johtuu siitä, että reaktioon osallistuvien aineiden konsentraatiot muuttuvat reaktion edetessä. Reaktionopeus ei siis pysy samana koko ajan. Reaktionopeus on yleensä suurimmillaan reaktion alussa ja pienenee reaktion edetessä.
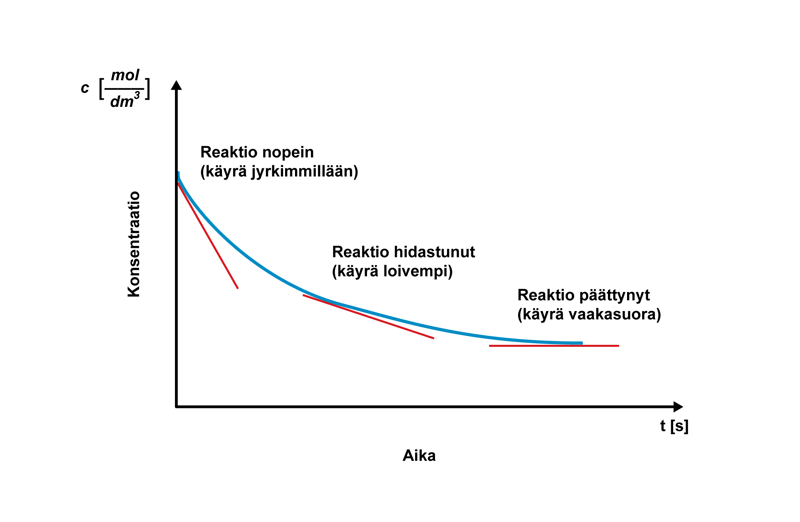
Mekaniikassa nopeuden muutosta ajan suhteen sanotaan kiihtyväksi tai hidastuvaksi liikkeeksi riippuen siitä, kasvaako vai pieneneekö kappaleen nopeus edelliseen mittaushetkeen verrattuna. Jos nopeuden muutos tapahtuu tasaisesti, puhutaan tasaisesti kiihtyvästä tai hidastuvasta liikkeestä. Edellä kuvatuissa tapauksissa reaktionopeus hidastui tasaisesti. Esimerkiksi räjähdyksissä etenevän reaktion nopeus voi kasvaa kiihtyvästi. Seurauksena voi olla eksponentiaalinen reaktionopeuden kasvu ja hallitsematon räjähdys.
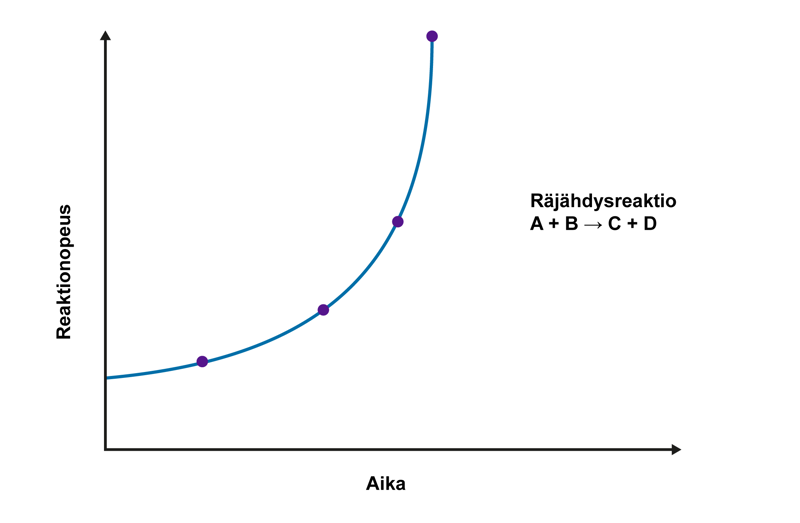
Yleensä lähtöaineen ja reaktiotuotteen konsentraation muutokset piirretään samaan kuvaajaan. Kuvion perusteella voidaan määrittää sekä lähtöaineiden että tuotteiden konsentraatioita, konsentraatioiden muutoksiin kuluvia aikoja ja reaktionopeuksia. Lisäksi lähtöaineita voi olla yksi tai useampia, samoin reaktiotuotteita.
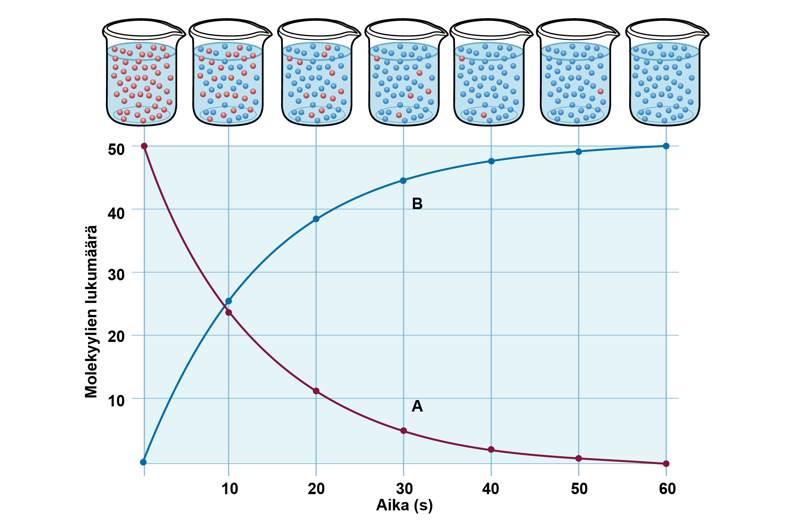
Keskimääräinen reaktionopeus
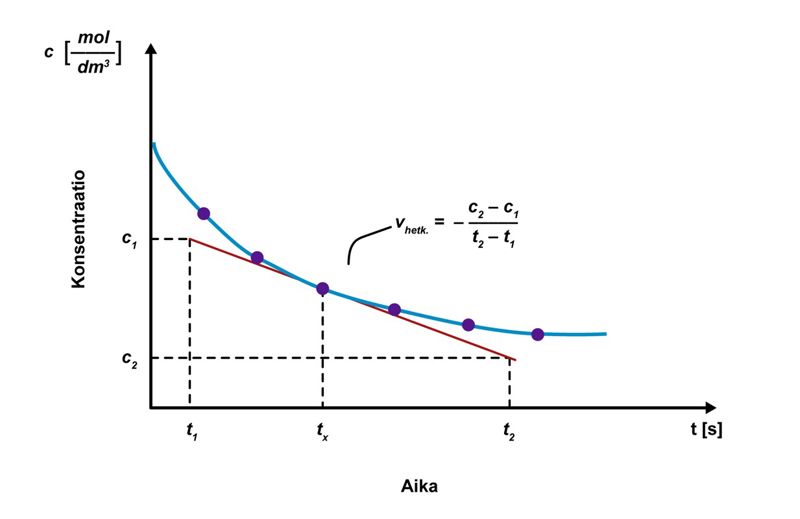
Keskimääräinen reaktionopeus määritellään matemaattisesti konsentraation muutoksena ajan suhteen. Tarkastellaan esimerkkinä reaktiota , jossa lähtöaineesta A muodostuu reaktiotuotetta B. Alussa lähtöaineen konsentraatio on maksimissaan, ja tuotetta ei ole ollenkaan. Yksinkertaistuksen vuoksi oheiseen kuvioon on merkitty vain lähtöaineen konsentraation muutos. Reaktion edetessä lähtöaine muuttuu reaktiotuotteeksi, jolloin lähtöaineen määrä pienenee ja tuotteen määrä kasvaa. Ajanhetkellä t1 lähtöaineen konsentraatio on c1 ja ajanhetkellä t2 sen määrä on pienentynyt konsentraatioon c2. Keskimääräinen reaktionopeus on siten ja yleisesti , jossa ∆c = konsentraation muutos () ja ∆t = aika (s). Reaktionopeuden yksikkö on .
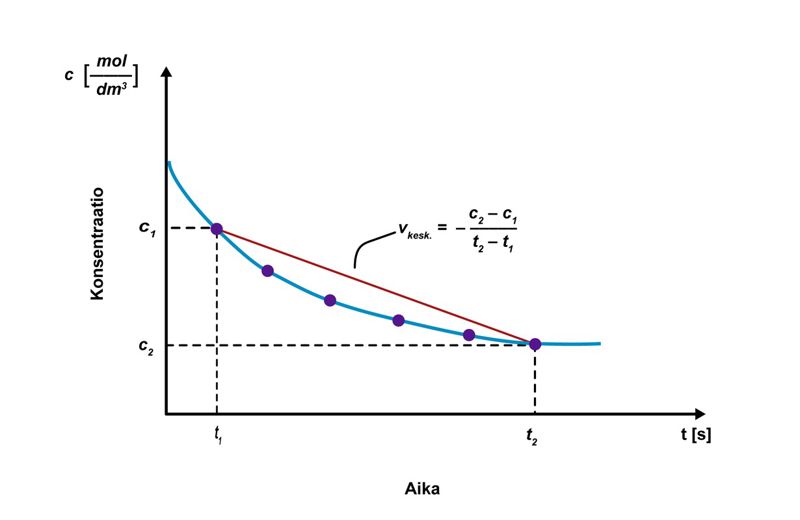
Reaktionopeus on aina lukuarvoltaan positiivinen. Lähtöaineen pitoisuus kuitenkin pienenee reaktion edetessä, joten lähtöaineelle c2 on aina pienempi kuin c1. Osoittajasta tulee näin ollen negatiivinen luku, joten reaktionopeuden kaavaan merkitään miinusmerkki. Tuotteen osalta c2 on aina suurempi kuin c1, osoittaja on positiivinen, eikä etumerkkiä tarvitse muuttaa. Tietyissä yhteyksissä miinusmerkkiä käytetään korostamaan tarkasteltavan aineen konsentraation pienentymistä.
Keskimääräinen reaktionopeus
Lähtöaine
Reaktiotuote
Hetkellinen reaktionopeus
Mitä lyhemmällä aikavälillä keskimääräistä reaktionopeutta tarkastellaan, sitä lähemmäksi hetkellistä reaktionopeutta tullaan. Hetkellinen reaktionopeus määritellään matemaattisesti raja-arvotarkasteluna, kun ajan muutos lähestyy nollaa: . Hetkellinen reaktionopeus tarkoittaa konsentraation muutosta kuvaavan funktion derivaattaa tässä pisteessä. Suuri reaktionopeus voidaan löytää derivaatan maksimikohdasta, ja reaktion päättyminen derivaatan nollakohdasta.
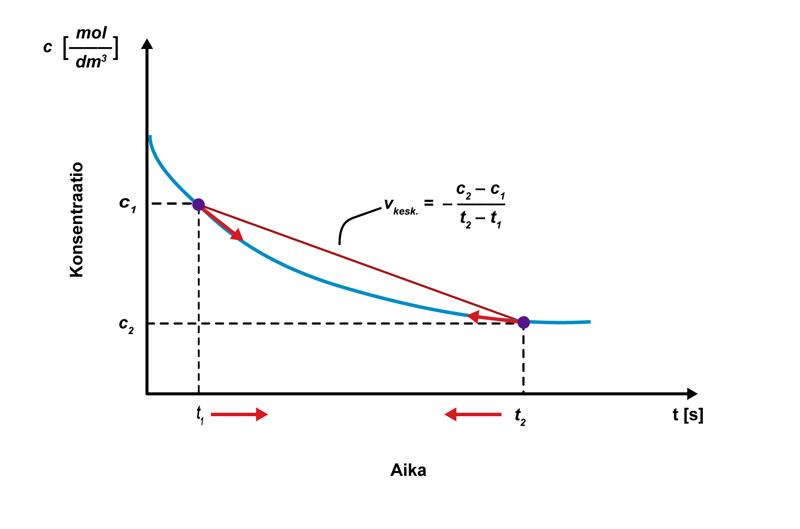
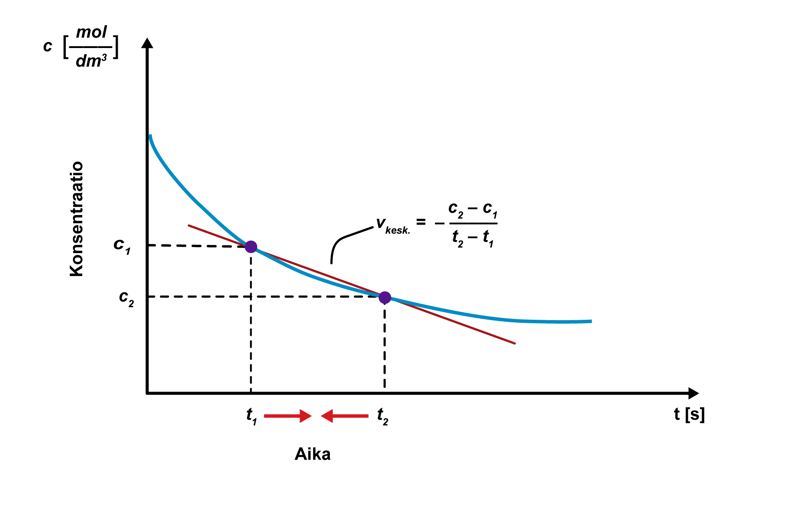
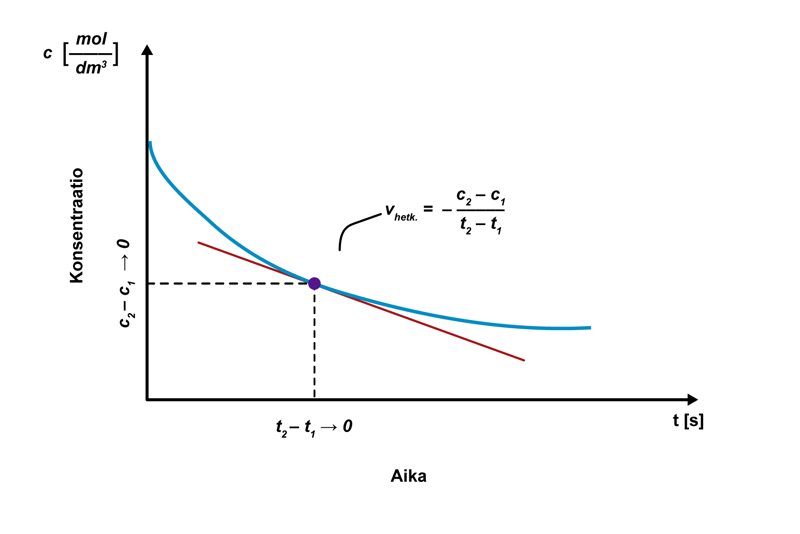
Hetkellinen reaktionopeus määritetään graafisesti piirtämällä tangentti konsentraation muutosta kuvaavan käyrän pisteeseen ajanhetkessä tx. Mitä suurempi tangentin kulmakerroin on, sitä suurempi on reaktionopeus. Reaktio on päättynyt, kun pisteeseen piirretty tangentti on vaaka-akselin suuntainen.
Hetkellinen reaktionopeus
Lähtöaine
Reaktiotuote



