Kemian perusideat
Kemian perusideat
Perusidea | Laki tai malli |
Ainetta tai energiaa ei voi luoda tyhjästä, eikä hävittää. | Aineen ja energian häviämättömyyden laki |
Kaikki aine koostuu pienistä rakenneyksiköistä, joita ovat mm. atomit, molekyylit ja ionit. | 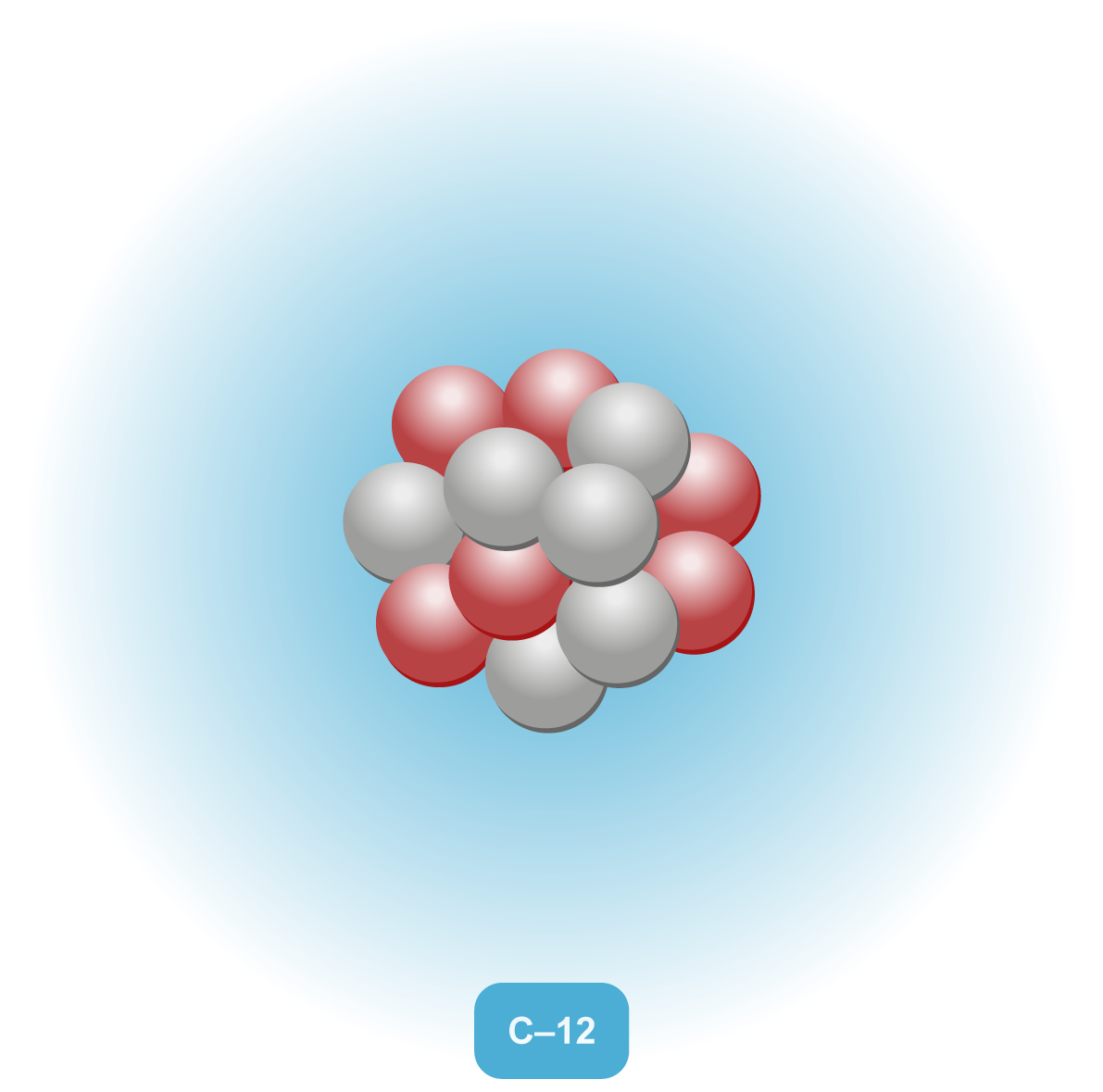 |
Rakenneyksiköt sitoutuvat toisiinsa sähköisin vetovoimin. Sidoksen voimakkuus ja sitoutumistapa vaihtelevat (erilaiset sidostyypit). Näistä johtuvat aineiden erilaiset ominaisuudet. | 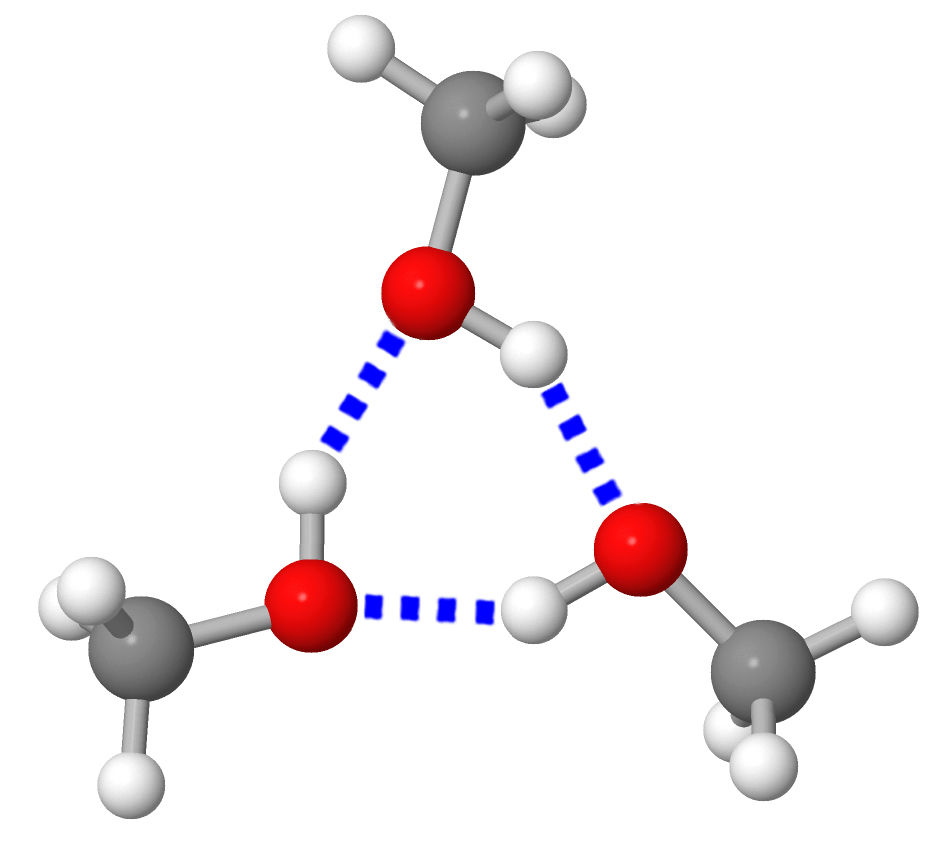 |
Rakenneyksiköt ovat koko ajan lämpöliikkeessä: ne etenevät, pyörivät ja värähtelevät. | 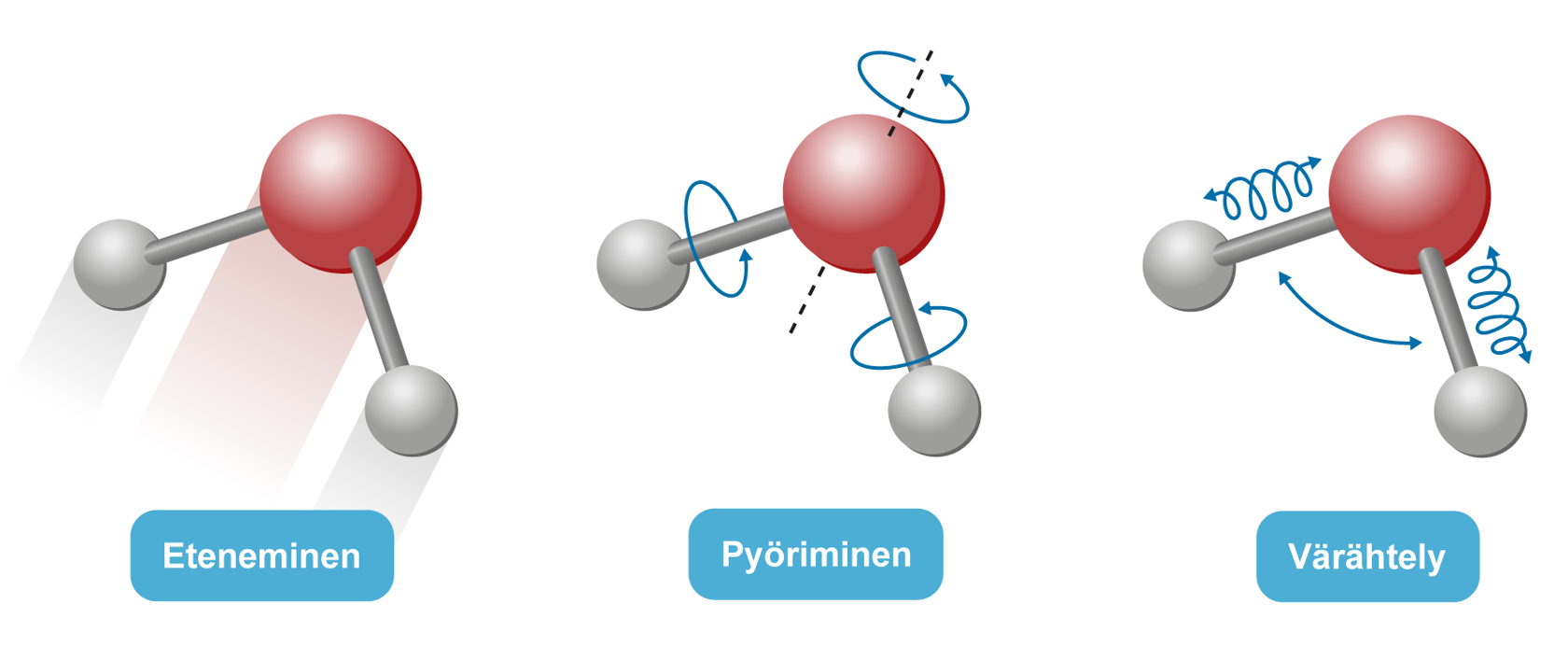 |
Rakenneyksiköiden törmätessä voi tapahtua kemiallinen reaktio. Törmäyksessä ne eivät voi ”koskettaa” toisiaan, ts. ne eivät koskaan liity fyysisesti kiinni toisiinsa. | 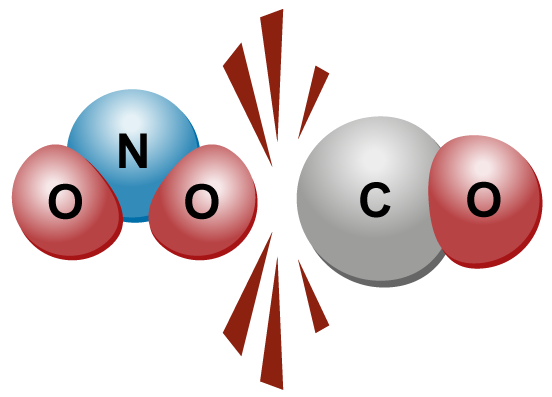 |
Atomimallien kehittyminen
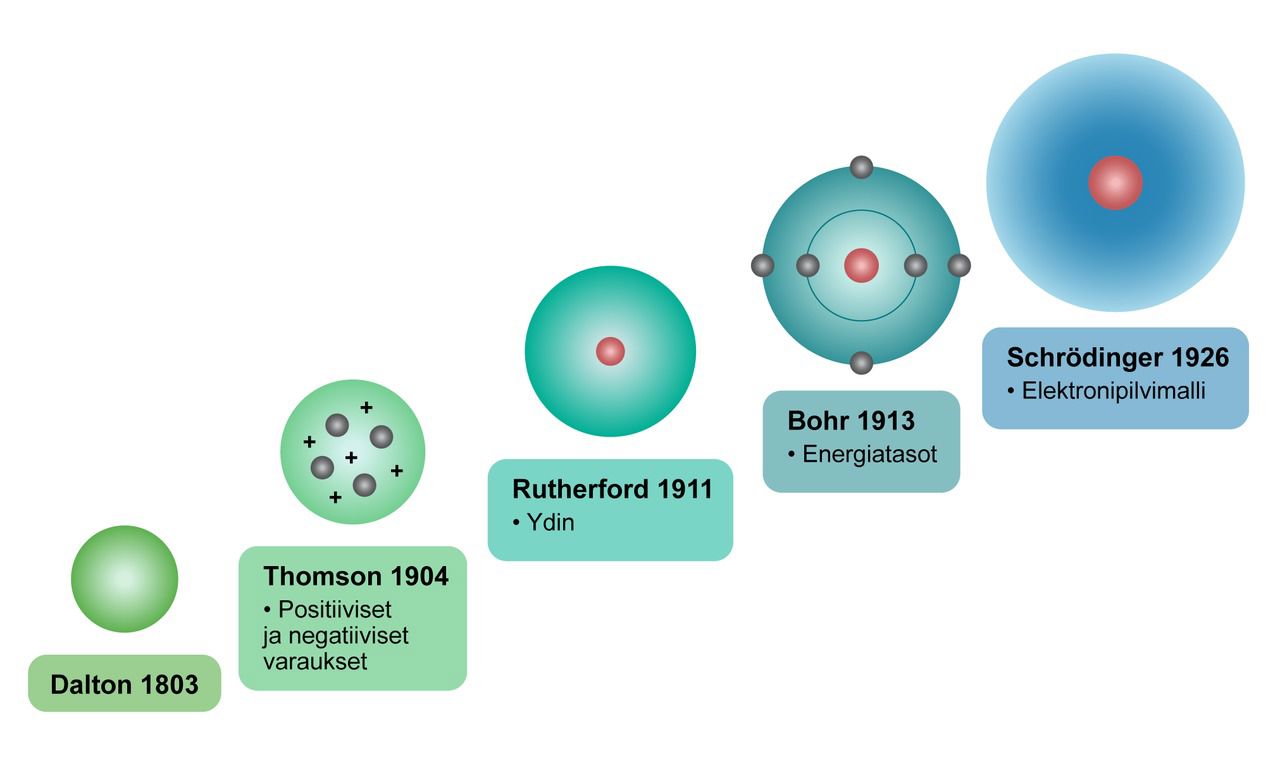
1800-luvun alussa John Dalton esitteli atomikäsitteen, joka avasi uusia näkökulmia alkuaineiden atomien massojen suhteiden selvittämiseen. Joseph Thomson löysi elektronin ja kehitti atomimallin, jossa atomi oli sähköisesti neutraali ja koostui positiivisesti varautuneesta ytimestä, jota ympäröivät negatiivisesti varautuneet elektronit. Ernest Rutherfordin tekemä sirontakoe puolestaan avasi tien uudelle atomimallille, jossa suurin osa atomin massasta keskittyi positiivisesti varautuneeseen ytimeen. Ytimen ympärillä kiersivät negatiivisesti varautuneet elektronit. Niels Bohr kehitti Rutherfordin mallia edelleen ottaen huomioon elektronien elliptiset radat ja elektronien sijainnit energiatasoilla. James Chadwickin löytö osoitti, että atomiytimessä oli myös varauksettomia neutroneita. Erwin Schrödingerin kehittämä kvanttimekaaninen atomimalli toi lisää yksityiskohtia ja selitti tarkemmin elektronien sijoittumisen atomin ympärille. Schrödingerin mallissa elektronien paikka määriteltiin todennäköisenä sijaintina jossain atomin ytimen läheisyydessä.
Atomin rakenne
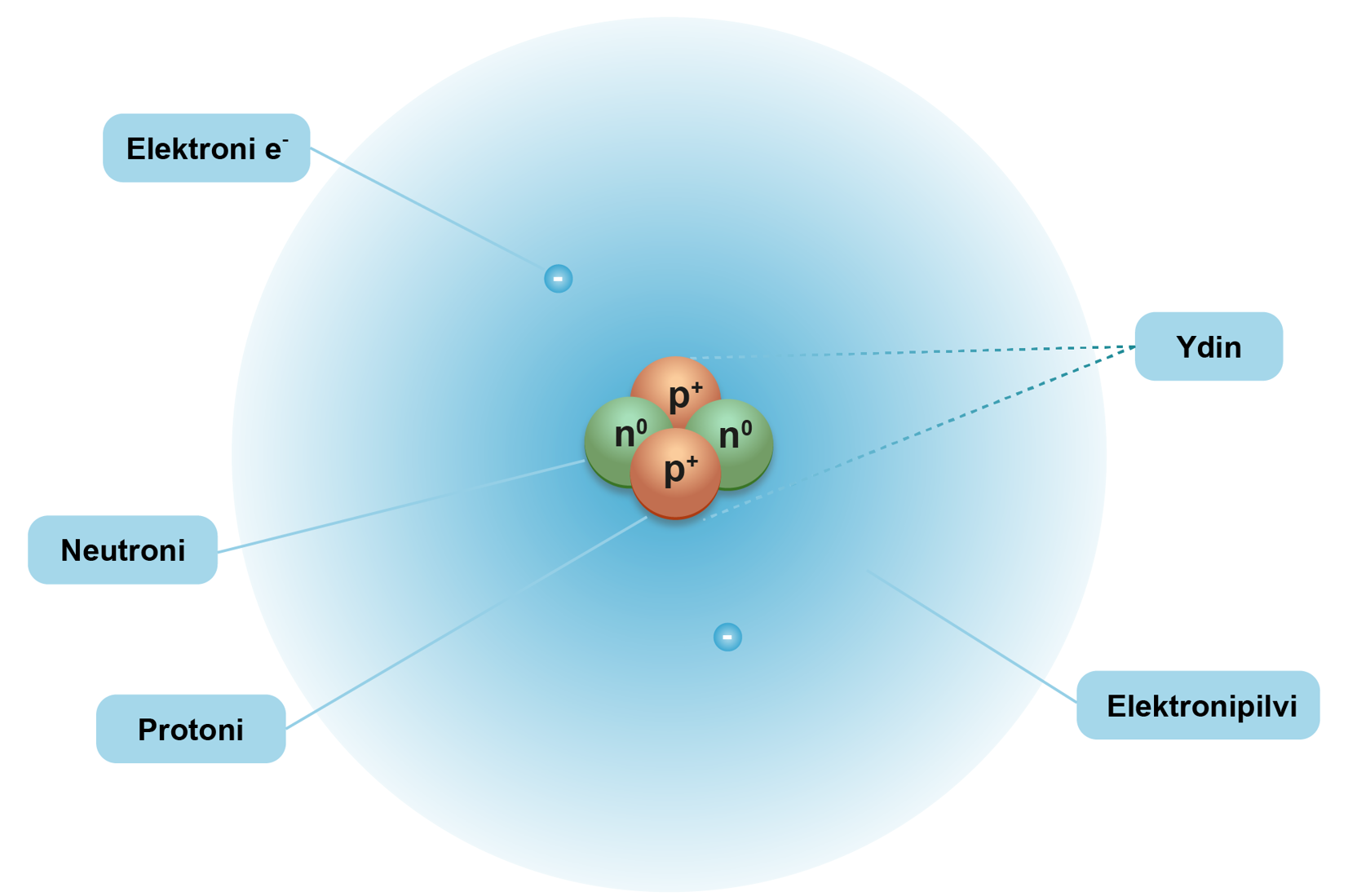
Atomi rakentuu ytimestä ja sitä ympäröivästä elektronien muodostamasta elektronipilvestä. Atomin ydin rakentuu protoneista ja neutroneista. Protonit, neutronit ja elektronit ovat alkeishiukkasia. Protonin varaus on +1 ja elektronin -1. Neutroni on varaukseton. Atomi kokonaisuutena on ulospäin varaukseton, koska atomissa on aina yhtä monta protonia ja elektronia.
Protonin massa on yli tuhat kertaa suurempi kuin elektronin massa. Neutronin massa on hieman protonin massaa suurempi. Ytimen massa muodostaa n. 99,9 % koko atomin massasta. Ytimen halkaisija on kymmenestä sataantuhanteen kertaa pienempi kuin koko atomin halkaisija. Atomin ytimen ja elektronipilven muodostama kokonaisuus on suurelta osin tyhjää tilaa.
Hiukkaset, massat ja varaukset
Tunnus | Varaus | Massa | |
protoni | p+ | +e | 1 836 me |
neutroni | n | 0 | 1 839 me |
elektroni | e− | −e | me |
Varaus e on alkeisvaraus (noin 1,602 · 10−19 C) ja massa me on elektronin massa (noin 9,109 · 10−31 kg).
a) Atomiydin sisältää
- neutroneja
- protoneja
- elektroneja.
b) Atomin halkaisija on noin
- 0,1 nm
- 0,1 Å
- 100 000 fm
- 1 Å.
c) Elektronin massa on
- suurempi kuin neutronin.
- pienempi kuin protonin.
d) Elektronit pysyvät atomiytimen ympärillä
- koska positiivinen ydin vetää puoleensa negatiivisia elektroneja.
- sähkömagneettisen vuorovaikutuksen seurauksena.
- koska positiiviset protonit vetävät niitä puoleensa.
Bohrin atomimalli
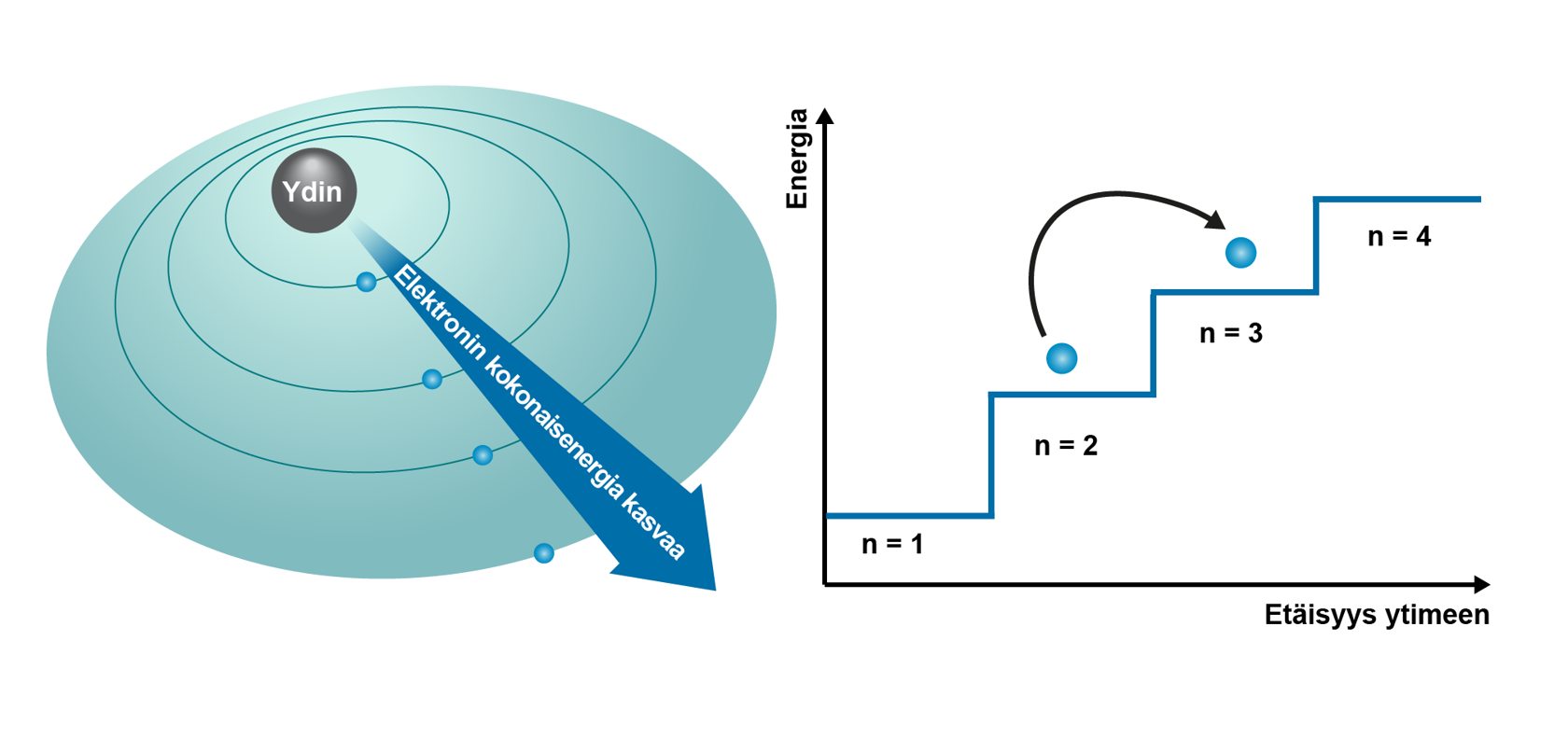
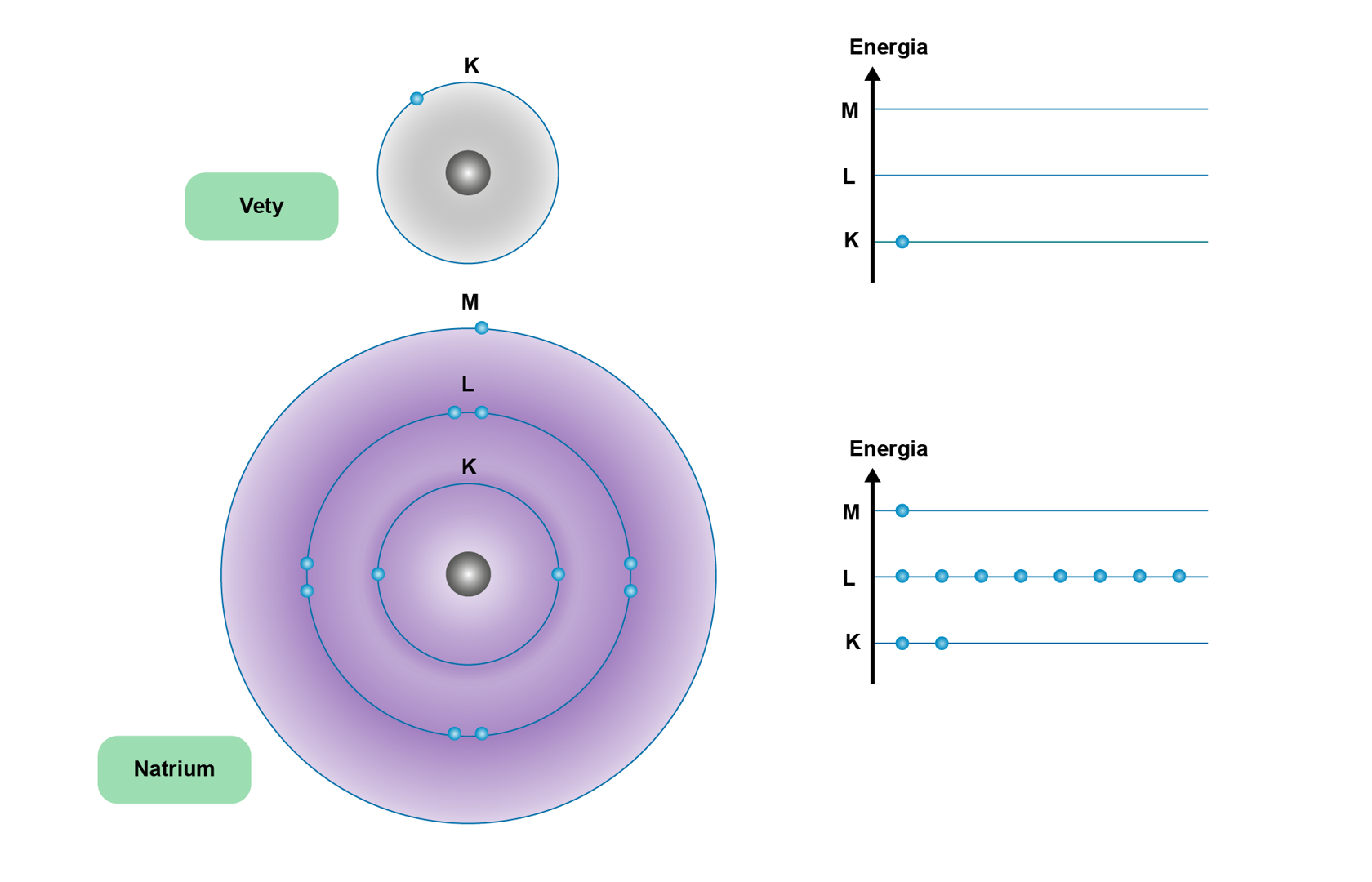
Bohrin atomimalli perustuu olettamukseen, että elektronit kiertävät atomin ytimen ympäri tiettyjä tarkoin määrättyjä ympyräratoja pitkin. Mallin mukaisesti elektronit pysyvät ytimen ympärillä sähkömagneettisen vuorovaikutuksen seurauksena. Elektronin kiertäessä ydintä sillä on liike-energiaa sekä ytimen ja elektronin etäisyyteen liittyvää asemaenergiaa. Näiden energioiden summa, kokonaisenergia, on pysyvällä atomilla vakio. Elektronin siirtyessä lähemmäksi ydintä sen asemaenergia pienenee ja liike-energia vastaavasti kasvaa. Elektronin siirtyessä kauemmaksi ytimestä sen asemaenergia kasvaa ja liike-energia pienenee. Elektronin paikka ja liikenopeus voivat vaihdella, mutta tietyt etäisyydet ovat muita todennäköisempiä. Näistä käytetään nimitystä elektronikuori (myös energiataso).
Elektronien maksimimäärät kuorilla määräytyvät kaavan 2n2 mukaan, jossa n = 1, 2, 3, ... sisimmästä elektronikuoresta lukien. Bohrin mallilla voidaan selittää hyvin vain jaksollisen järjestelmän pääryhmien (1, 2 ja 13–18) elektronirakenteita. Kemiallisissa reaktioissa vain uloimman kuoren elektronit osallistuvat reaktioihin. Elektroneja voi poistua tai tulla lisää atomeihin, jolloin tapahtuu atomin ionisoituminen. Elektronin siirtyessä atomilta toiselle tapahtuu kemiallinen reaktio.
Alkuaineet ja isotoopit
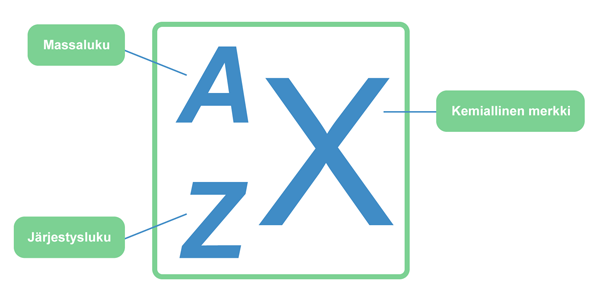
Alkuaine on atomi, jolla on tietty määrä protoneja ytimessään, eikä sitä voida jakaa kemiallisilla menetelmillä pienempiin osiin. Tällaisia alkuaineita tunnetaan tällä hetkellä noin 120. Uusimmat ja raskaimmat alkuaineet on valmistettu laboratoriossa. Alkuaineen perusrakenneyksikkö on atomi tai molekyyli. Esimerkiksi vety, typpi, happi ja kloori esiintyvät kahden atomin muodostamina molekyyleinä. Toisaalta hiili, fosfori, rikki ja tina voivat esiintyä useamman alkuaineatomin muodostamina allotrooppisina rakenteina, kuten grafiittina, timanttina ja fullereenina. Nämä eri muodot ovat erilaisia fysikaalisilta ja kemiallisilta ominaisuuksiltaan.
Alkuaineen järjestysluku Z määräytyy ytimessä olevien protonien lukumäärän perusteella ja ilmoitetaan alkuaineen kemiallisen merkin edessä alaindeksinä. Alkuaineen massaluku A puolestaan kertoo ytimessä olevien protonien ja neutronien yhteenlasketun lukumäärän ja merkitään alkuaineen kemiallisen merkin eteen yläindeksinä. Isotoopit ovat samoja alkuaineita, joissa on yhtä monta protonia mutta eri määrä neutroneja. Luonnossa esiintyvät aineet ovat isotooppiseoksia, ja neutronit ovat tarpeellisia tasapainottamaan ytimen rakennetta. Hiilen yleisin ja pysyvin muoto on sen isotooppi, jossa on kuusi protonia ja kuusi neutronia. Isotoopit voivat hajota radioaktiivisen hajoamisen kautta muuttuen pysyvämmiksi muodoiksi.
Tutki PhET-simulaatiota, jossa voit tutustua kemialliseen merkkiin ja pelata peliä, joka liittyy atomin rakenteeseen ja isotooppeihin.
Peli kertoo sinulle, kuinka hyvin osasit asian. Voit aloittaa pelin painamalla kohtaa "Aloita peli".
Alkuaineen elektroniverhon jalokaasurakenne
Oktettisäännön mukaan atomien uloimmalle energiatasolle muodostuu pysyvä kahdeksan elektronin rakenne, kun atomit muodostavat yhdisteitä. Oktettisäännöstä on poikkeuksia, ja sääntö pätee hyvin vain atomeille, joiden Z < 20. Oktettisäännön sijaan sanotaan atomin saavuttavan jalokaasurakenteen. Tämäkään malli ei selitä kaikkia atomien välisiä sidoksia.
Jalokaasuatomeilla on muihin alkuaineisiin verrattuna energeettisesti edullisempi ja siksi pysyvämpi elektronirakenne. Muiden alkuaineiden ionisoituessa tai muodostaessa yhdisteitä niiden elektronirakenne muuntuu jalokaasuatomien elektronirakennetta muistuttavaksi. Jalokaasuatomeista heliumilla on kaksi elektronia ainoalla energiatasollaan. Neonilla on sisimmällä energiatasollaan kaksi ja seuraavalla kahdeksan elektronia. Argonilla on sisimmällä kaksi, seuraavalla kahdeksan ja kolmannella myös kahdeksan elektronia.
Ylioppilaskoetehtäviä
Millä seuraavista ioneista on jalokaasuatomin elektronirakenne?
- H-
- Cu2+
- Xe2+
- Pb2+
Saman alkuaineen sähköisesti neutraaleilla atomeilla on aina
- sama järjestysluku ja sama massaluku.
- sama massaluku.
- sama elektronien ja protonien lukumäärä.
- yhtä monta neutronia ytimissään.
Mitä yhteistä on ionilla ja atomilla ?
- sama määrä protoneja
- sama määrä elektroneja
- samat kemialliset ominaisuudet
- sama määrä ulkoelektroneja
