Lämpökemiaa ja termodynamiikkaa
Energian käsite kehitettiin 1800-luvun alkupuolella. Kemian näkökulmasta energia on tärkeä ja keskeinen asia. Energiaa tutkimalla voidaan esimerkiksi päätellä, mitkä reaktiot voivat tapahtua ja mitkä eivät, ja tietoa voidaan hyödyntää esimerkiksi lääkkeiden kehittämisessä.
Energiaan liittyy olennaisesti tässä luvussa esiteltävä käsite termodynamiikka. Termodynamiikan käsite on syntynyt havainnoista, jotka osoittivat lämmön voivan muuttua muiksi energian muodoiksi, kuten kemialliseksi energiaksi. Kemiassa termodynamiikka tutkii reaktioissa tapahtuvia energian muutoksia. Termodynamiikan tutkimusalaa kutsutaan lämpö- tai termokemiaksi.
Kemiallinen energia
Kemiassa energia esiintyy potentiaalienergiana ja kineettisenä energiana. Potentiaalienergia sitoutuu kemiallisiin sidoksiin. Se vaikuttaa aineen rakenneosien välisessä vuorovaikutuksessa. Esimerkiksi reaktioissa, joissa tapahtuu kemiallisten sidoksien katkeamista ja uusien syntymistä, potentiaalienergia ilmenee lämpöenergian sitoutumisena ja vapautumisena tai säteilyenergiana. Kineettinen energia ilmenee eri rakenneosien eli atomien ja molekyylien liikkeenä. Ne etenevät, pyörivät ja värähtelevät.
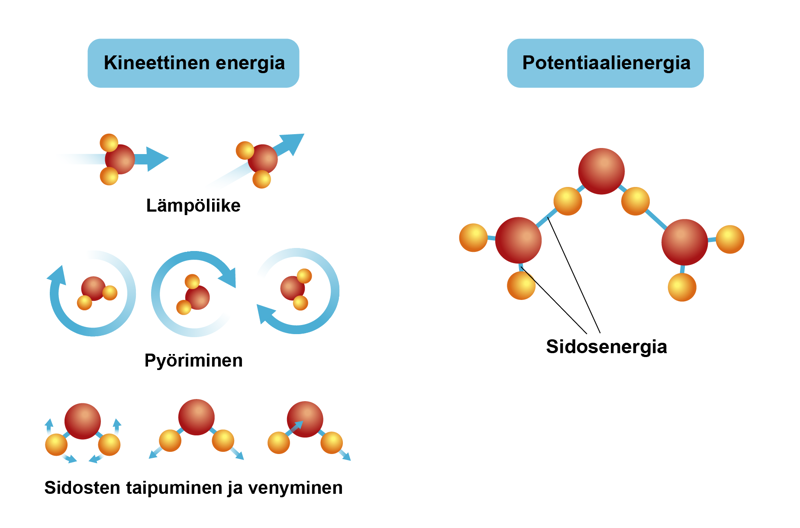
Energialajit kemiallisissa reaktioissa
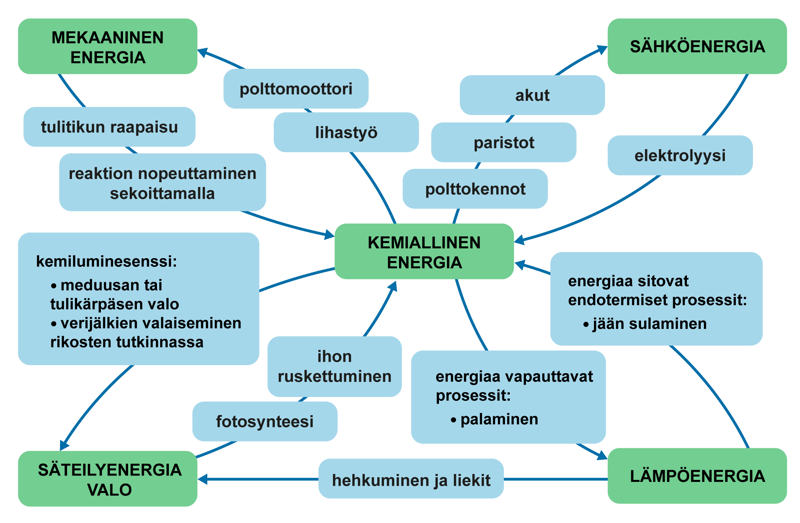
Energiaa sitoutuu ja vapautuu kaikissa kemiallisissa ilmiöissä. Energia voi muuntua lajista toiseen. Muuntuminen voi tapahtua useaan kertaan saman kemiallisen ilmiön aikana, ja energianmuutos voi tapahtua molempiin suuntiin. Esimerkiksi räjähdyksessä kemiallisiin sidoksiin varastoitunut energia voi muuntua sähkö-, lämpö- ja säteilyenergiaksi. Samoin ruoka-aineissa oleva energia muuntuu elimistössä mekaaniseksi energiaksi ja lämpöenergiaksi, jotka ilmenevät lihastyönä ja ruumiin lämpönä.
Opintojaksolla KE5 tarkastellaan erityisesti reaktioissa sitoutuvaa tai vapautuvaa lämpöenergiaa ja sähköenergiaa. Lämpöenergiaa vapauttavaa reaktiota nimitetään yleensä eksotermiseksi reaktioksi ja lämpöenergiaa sitovaa reaktiota endotermiseksi reaktioksi. Esimerkiksi palaminen on eksoterminen reaktio ja perunoiden kypsyminen kiehuvassa vedessä endoterminen reaktio. Sähköenergia on tärkeä kemiallisen energian osa-alue, johon törmää arjessa joka päivä. Kemian avulla tuotettua sähköenergiaa hyödynnetään esim. paristoissa, akuissa ja polttokennoissa. Sähkökemiallisia ilmiöitä tarkastellaan myös fysiikassa.
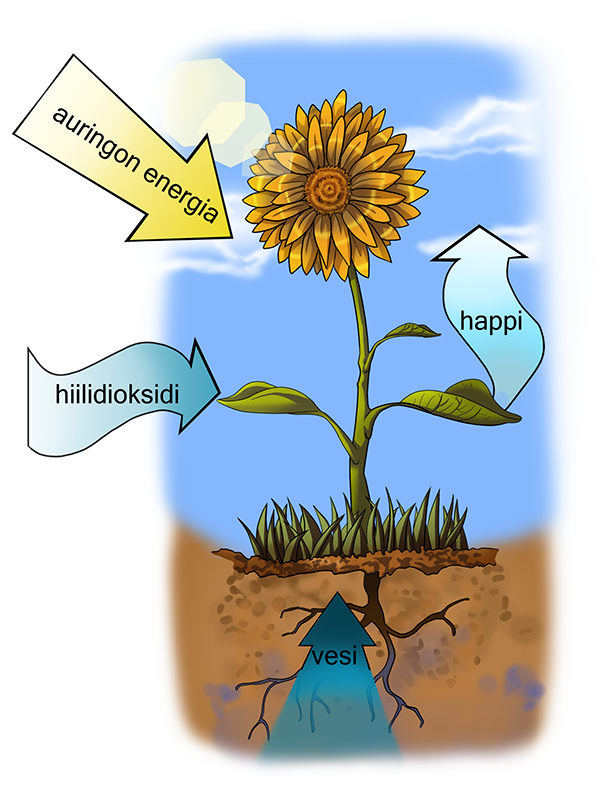
Säteilyenergia ilmenee tavallisimmin valona ja lämpönä. Esimerkiksi palamisessa havaitaan liekki, valo, väri ja lämpöilmiöitä. Magnesiumin palaessa muodostuu valkoista, kirkasta valoa. Palaessa muodostuu myös silmille haitallista UV-säteilyä, joten liekkiin katsottaessa pitää käyttää suojalaseja. Metallisuolojen kuumentaminen kaasupolttimen liekissä aiheuttaa ionien virittymistä, ja viritystilan purkautuessa sitoutunut energia vapautuu eri aallonpituuden omaavana säteilynä. Ne havaitaan erivärisinä liekkeinä tai hehkumisena. Elämän kannalta ehdottomasti merkittävin säteilyenergiaan liittyvä ilmiö on luonnossa tapahtuva fotosynteesi.
Fotosynteesissä eli yhteyttämisessä kasvi sitoo auringon säteilyenergiaa orgaanisiin yhdisteisiin, kuten sokereihin. Yhteyttämiseen kasvi tarvitsee vettä ja hiilidioksidia. Lukio-opinnoissa säteilyyn liittyviä asioita pohditaan kemian lisäksi fysiikassa ja biologiassa.
Termodynamiikkaa ja reaktiokinetiikkaa
Teoreettisen kemian tutkimuksen lähtökohtana on atomien ja molekyylien asemiin ja liikkeeseen perustuva mallin rakentaminen, mikä selittäisi reaalimaailman havaintoja. Esimerkiksi erilaiset atomirakenteisiin ja tasapainotiloihin liittyvät selitysmallit kiinnittävät huomiota juuri tähän. Näissä tapauksissa ilmiöitä tarkastellaan kineettisestä näkökulmasta, minkä lisäksi niitä voidaan tarkastella termodynaamisesta näkökulmasta.
Termodynamiikka tutkii luonnonilmiöissä tapahtuvia energianmuutoksia yleensä suurten hiukkasjoukkojen tapauksessa. Kiinnostus ilmiöiden termodynaamisiin tarkasteluihin alkoi höyrykoneiden hyötysuhteen parantamiseen liittyvistä käytännöllisistä ongelmista, mutta laajeni sittemmin omaksi oppialaksi. Termodynamiikalla on keskeinen merkitys kemian lisäksi fysiikassa, biologiassa, insinööritieteissä ja lääketieteessä.
Kemiassa termodynamiikka tarkastelee mm. molekyylien ja yhdisteiden välisiin sidoksiin sitoutunutta energiaa eli sidosenergioita. Kemialliset reaktiot ovat sidosten hajoamista ja uusien sidosten muodostumista ja niihin liittyy aina energianmuutoksia. Tutkimuksen tavoitteena on kehittää energiamuutoksiin liittyviä sääntöjä, joiden perusteella voidaan ennustaa mitkä reaktiot ovat mahdollisia ja mitkä eivät voi tapahtua. Termodynamiikassa luotujen mallien perusteella voidaan ennustaa, mitkä reaktiot ovat spontaaneja eli tapahtuvat itsestään, ja mitkä reaktiot ovat pakotettuja eli eivät käynnisty itsestään, mutta ne saadaan aikaan muuttamalla reaktio-olosuhteita (esim. lämpö, paine tai happamuus) tai katalysoimalla. Reaktioiden energiamuutoksiin liittyvää kemian osa-aluetta nimitetään lämpö- tai termokemiaksi.
Termodynamiikan ja reaktiokinetiikan tuntemus on erityisen tärkeää kemian teollisuudessa. Esimerkiksi teolliset prosessit voidaan optimoida niiden avulla mahdollisimman tehokkaiksi ja puhtaiksi. Biokemiassa tarvitaan tietoa entsyymien katalysointimekanismeista, joiden pohjalta voidaan ymmärtää paremmin solujen toimintaa ja kehittää tehokkaampia ja puhtaampia tuotantomenetelmiä esim. elintarviketeollisuudelle. Lääketeollisuudessa tarvitaan tietoa lääkeaineiden hajoamisnopeuksista ja vaikutusajoista elimistössä.
Sisäenergia
Termodynamiikan ensimmäinen pääsääntö on energian häviämättömyyden laki. Kemiallisissa ilmiöissä aineen ja energian määrä on sama ennen reaktiota ja sen jälkeen. Energia voi muuntua muodosta toiseen, mutta mistään ei tule lisää energiaa, eikä mitään häviä pois.
Kaikkia termodynamiikassa tarkasteltavia kokonaisuuksia nimitetään systeemeiksi. Systeemin muodostaa esim. tietty määrä jotain ainetta. Avoin systeemi voi vaihtaa ympäristön kanssa ainetta ja energiaa. Suljettu systeemi voi vaihtaa ympäristön kanssa energiaa, mutta ei ainetta. Eristetty systeemi ei voi vaihtaa ympäristön kanssa ainetta eikä energiaa.
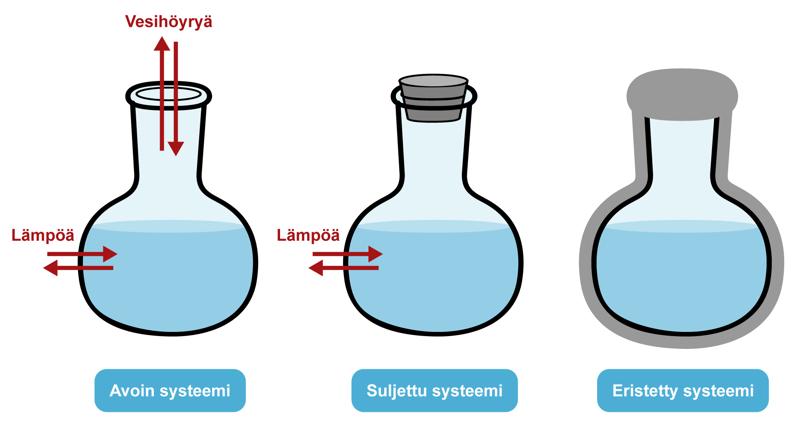
Homogeeninen systeemi sisältää ainoastaan yhden faasin. Esimerkiksi kaasu tai puhdas neste muodostaa homogeenisen systeemin. Heterogeeninen systeemi sisältää kaksi tai useampia faaseja. Suljetussa astiassa oleva vesi ja vesihöyry muodostavat heterogeenisen systeemin, jossa on nestefaasi ja kaasufaasi. Faasi käsitetään aina homogeeniseksi. Kaasut sekoittuvat toisiinsa missä suhteessa tahansa, joten systeemissä on vain yksi faasi, ellei niiden välissä ole väliseinää. Kiinteissä ja nestemäisissä aineissa voi esiintyä useampia faaseja yhtä aikaa.
Systeemin siirtyminen jostakin tilasta A tilaan B on tilanmuutos. Tapa, jolla muutos tapahtuu, on prosessi. Systeemin siirtyminen tilasta A tilaan B merkitsee aina samaa muutosta sen ominaisuuksissa. Sen sijaan tapa eli prosessi, joka johtaa tilanmuutokseen A:sta B:hen, voi vaihdella suuresti.
Systeemi on termodynaamisessa tasapainotilassa, jos sen havaittavissa ominaisuuksissa ei tapahdu muutosta pitkänkään ajan kuluessa. Tällaisessa systeemissä vallitsee lämpötasapaino, kemiallinen tasapaino ja mekaaninen tasapaino. Kaikki johonkin systeemiin sisältyvien energioiden summa on tämän systeemin sisäistä energiaa, . Sisäenergian absoluuttisen arvon määrittäminen on haastavaa, koska se riippuu monimutkaisista hiukkasten välisistä vuorovaikutuksista ja termodynamiikassa tarkastellaan suuria hiukkasjoukkoja. Termodynamiikassa kuitenkin riittää sisäenergian muutoksen tietäminen. Tämän muutoksen mittaaminen on paljon helpompaa. Termodynamiikan ensimmäisestä pääsäännöstä seuraa myös, että systeemin sisäenergia on riippuvainen vain siitä tilasta, jossa se on, ei siitä, miten systeemi on tilaan tullut. Esimerkiksi virvoitusjuomapullossa olevan juoman sisäinen energia on NTP-olosuhteissa aina sama riippumatta siitä, miten se on valmistettu ja siihen tilaan saatettu.
Vesimolekyyleillä on sitä enemmän liike-energiaa, mitä lämpimämpää vesi on. Molekyylien lämpöliike koostuu monenlaisesta liikkeestä. Pistemäiseksi ajateltu vesimolekyyli voi liikkua suoraviivaisesti eteenpäin ja törmätessään muuttaa suuntaansa. Vesimolekyylit myös pyörivät ja sidokset värähtelevät. Sidosvärähtelyissä atomien väliset etäisyydet ja rakenneosien väliset kulmat muuttuvat koko ajan. Liike-energian lisäksi vesimolekyylien kovalenttisissa sidoksissa ja molekyylien välisissä sidoksissa on sähköisistä vuorovaikutuksista johtuvaa potentiaalienergiaa. Kaikkien edellä mainittujen energioiden summa on veden sisäenergia . Systeemin siirtyessä tilasta A tilaan B sisäisen energian muutos on . Esimerkiksi lämmitettäessä vesi 20 °C:sta 30 °C:een sisäenergian muutos riippuu ainoastaan systeemin muutoksen aikana vastaanottamasta energiamäärästä.
Jos sisäenergia kasvaa,

Testaa tietosi
1. Kemiallinen energia voi muuntua eri energialajeiksi.
- oikein
- väärin
2. Energiaa vapauttavaa reaktiota kutsutaan
- eksotermiseksi reaktioksi.
- endotermiseksi reaktioksi.
3. Palaminen on
- eksoterminen reaktio.
- endoterminen reaktio.
4. Termodynamiikka käsittelee
- molekyylien liikettä.
- ilmiöihin liittyviä energianmuutoksia.
5. Spontaanit reaktiot ovat pakotettuja reaktioita.
- oikein
- väärin
6. Potentiaalienergia syntyy rakenneosien värähtelystä ja liikkeestä.
- oikein
- väärin
