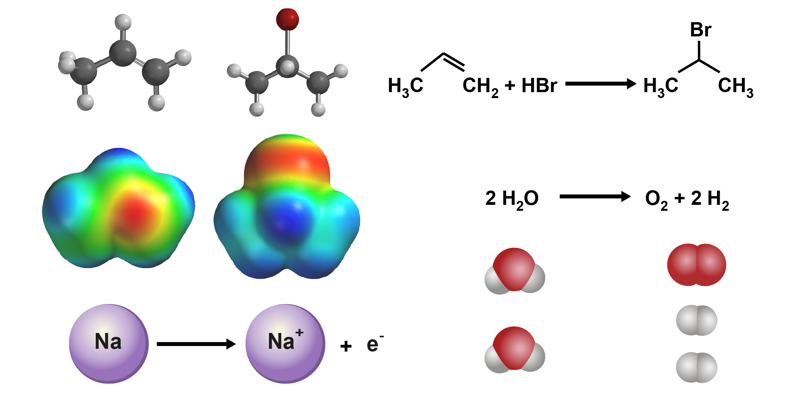
Kemialliset reaktiot

Kemialliset reaktiot ovat kemian tieteenalan tärkeä tutkimuskohde, sillä niiden ymmärtäminen, hallitseminen ja hyödyntäminen tekevät kemiasta tieteen. Kemian lisäksi monet muut tieteet hyödyntävät kemiallisia reaktioita.
Esimerkkejä
- Kemiallisten reaktioiden mahdollisimman tehokas hyödyntäminen on kemianteollisuuden perusta.
- Reaktioiden avulla valmistetaan lääkeaineita ja kosmetiikkaa.
- Ruoanlaitto ja ravintoaineiden säilöminen perustuvat kemiallisiin reaktioihin. Ruoanlaiton kemia on jopa oma tieteenalansa, molekyyligastronomia.
- Ihmisten ja eläinten fysiologia perustuu kemiallisiin reaktioihin, samoin luonnon toiminta. Mieti esimerkiksi aineiden (mm. vesi, hiili ja typpi) kiertokulkua, ilmakehää tai vaikka niinkin arkista ilmiötä kuin hyttysen puremaa.
Kuvagalleria: Kemiallisia reaktioita elinympäristössä
Kemiallisen reaktion tunnuspiirre
Kemiallisen reaktion keskeinen tunnuspiirre on aineen rakenteen muuttuminen. Aistein havaittavat muutokset ovat seurausta atomitason rakenteiden muutoksista. Reaktioiden submikrotason, eli atomien ja elektronien kokoluokan tarkastelussa nähdään, miten atomien ja molekyylien elektronijakaumat muuttuvat.
Reaktioissa lähtöaineatomien väliset sidokset heikkenevät ja uusia sidoksia muodostuu samalla, kun atomit järjestäytyvät uudelleen. Muutoksen suunta on aina kohti tasapainotilannetta tai pysyvämpää rakennetta. Reaktion aikana ilmenee energian muutoksia, kuten lämpö- tai valoilmiöitä. Reaktioon kuluu myös aina jokin aika.
Reaktion tapahtuminen
Vain oikealla nopeudella ja oikeasta suunnasta tapahtuvat reaktiokykyisten rakenneosien väliset törmäykset johtavat siihen, että lähtöaineista muodostuu reaktiotuotteita. Reaktiokykyisten aineiden lisäksi kemiallinen reaktio edellyttää oikeita ulkoisia olosuhteita. Tilanteesta riippuen vaaditaan tietty lämpötila, säteilyn määrä, tietty paine tai pitoisuus tai muu tekijä, jotta reaktio tapahtuu. Olosuhdemuuttujia voi olla yksi tai useampi.
Esimerkiksi vety- ja happimolekyylit törmäilevät huoneen lämpötilassa jatkuvasti toisiinsa, mutta reaktioon johtavia törmäyksiä ei tapahdu merkittävässä määrin. Kun kaasujen liike-energiaa lisätään kuumentamalla, suotuisia törmäyksiä tapahtuu enemmän ja yhä useampi törmäyksistä johtaa kemialliseen reaktioon.
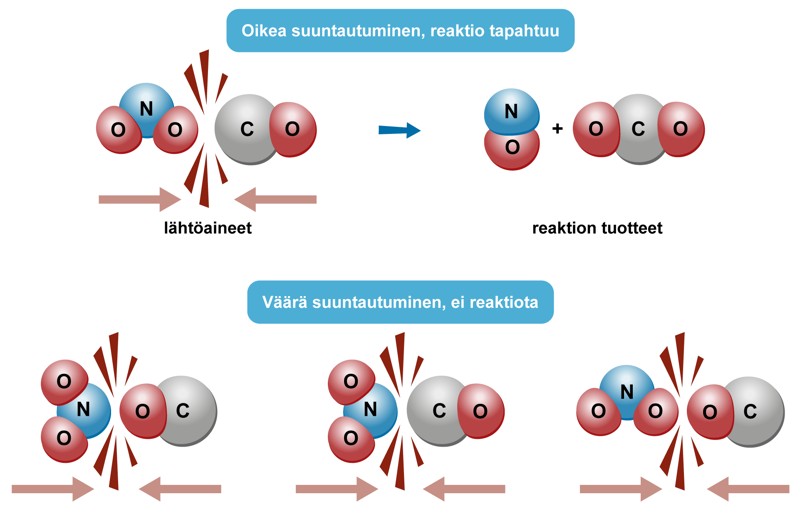
Kertaa kemian perusideat
Kemian perusideat
Perusidea | Laki tai malli |
Ainetta tai energiaa ei voi luoda tyhjästä, eikä hävittää. | Aineen ja energian häviämättömyyden laki |
Kaikki aine koostuu pienistä rakenneyksiköistä, joita ovat mm. atomit, molekyylit ja ionit. | 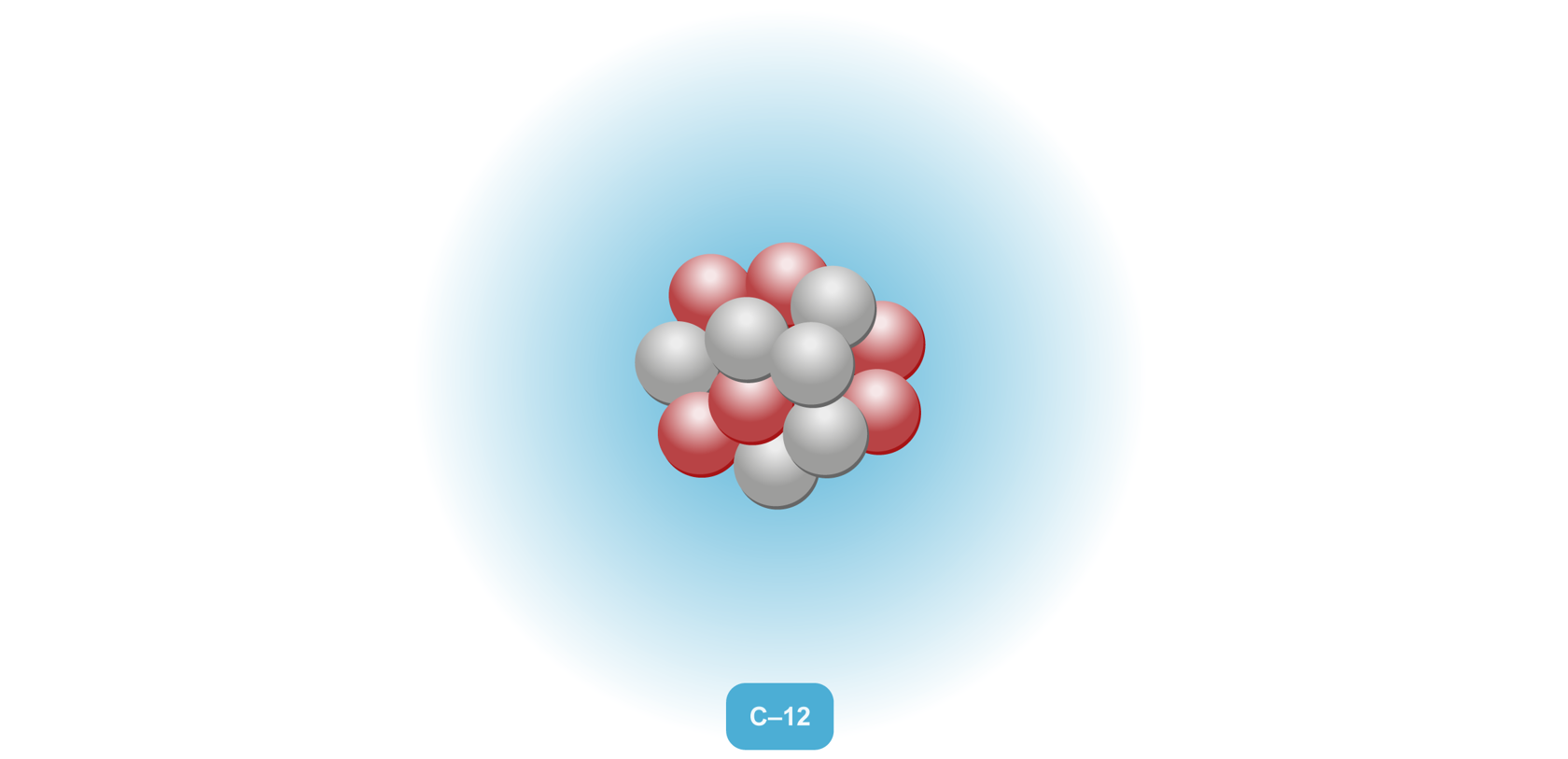 |
Rakenneyksiköt sitoutuvat toisiinsa sähköisin vetovoimin. Sidoksen voimakkuus ja sitoutumistapa vaihtelevat (erilaiset sidostyypit). Näistä johtuvat aineiden erilaiset ominaisuudet. | 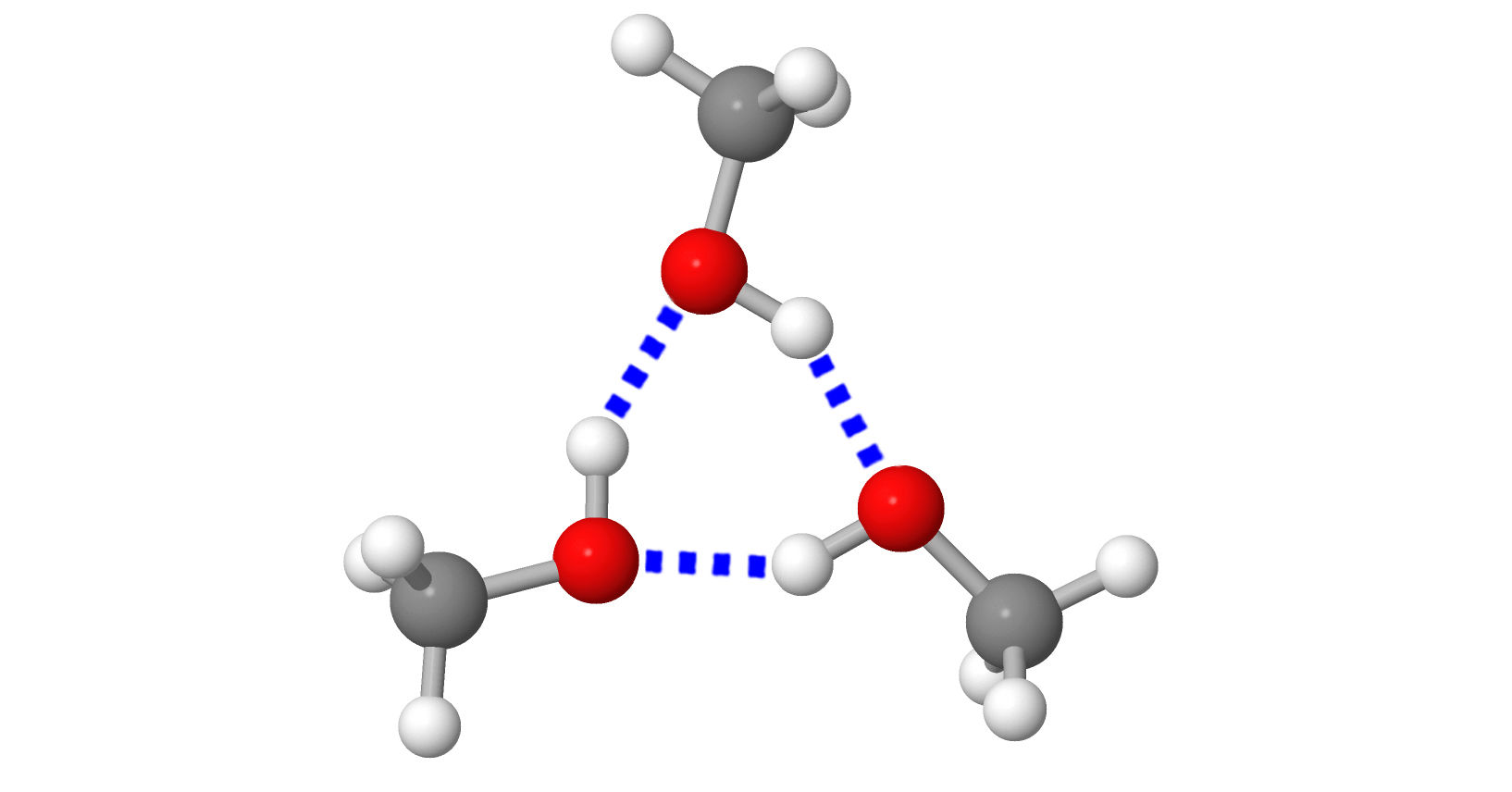 |
Rakenneyksiköt ovat koko ajan lämpöliikkeessä: ne etenevät, pyörivät ja värähtelevät. | 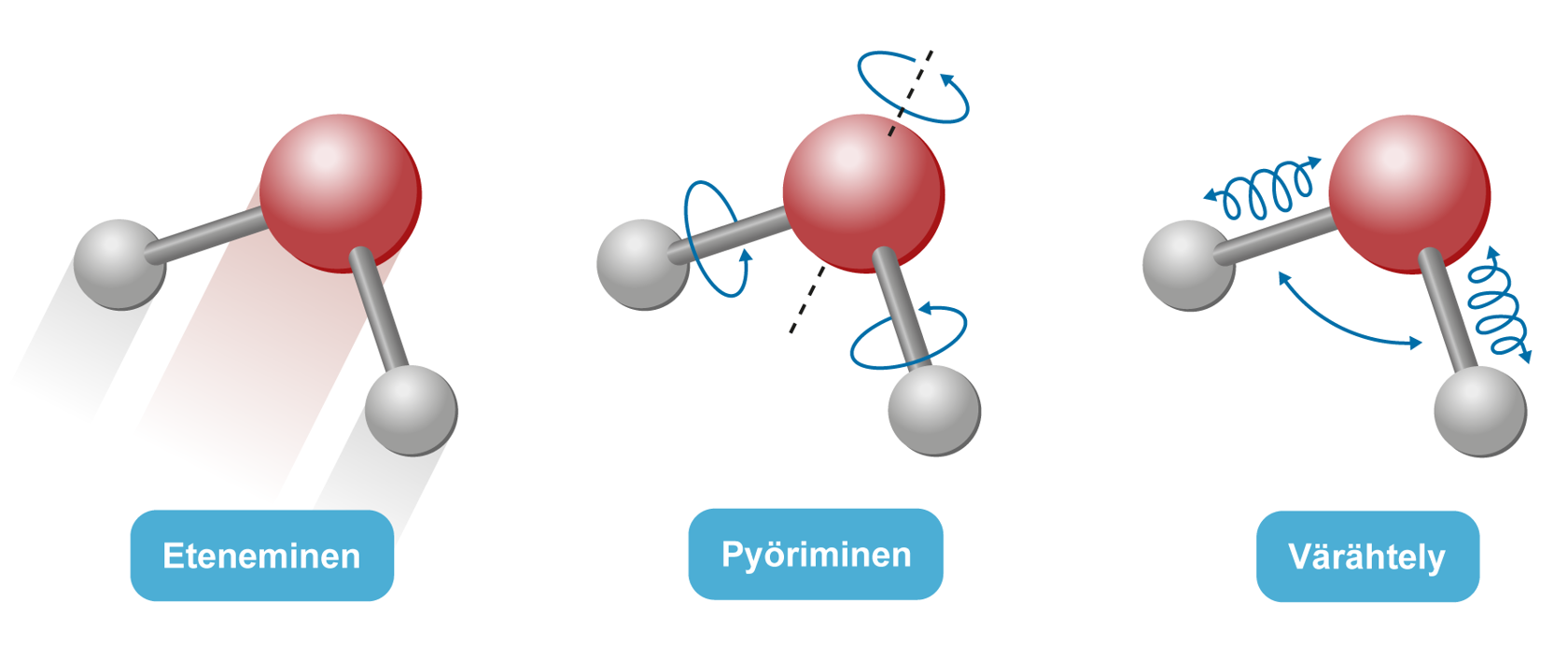 |
Rakenneyksiköiden törmätessä voi tapahtua kemiallinen reaktio. Törmäyksessä ne eivät voi ”koskettaa” toisiaan, ts. ne eivät koskaan liity fyysisesti kiinni toisiinsa. | 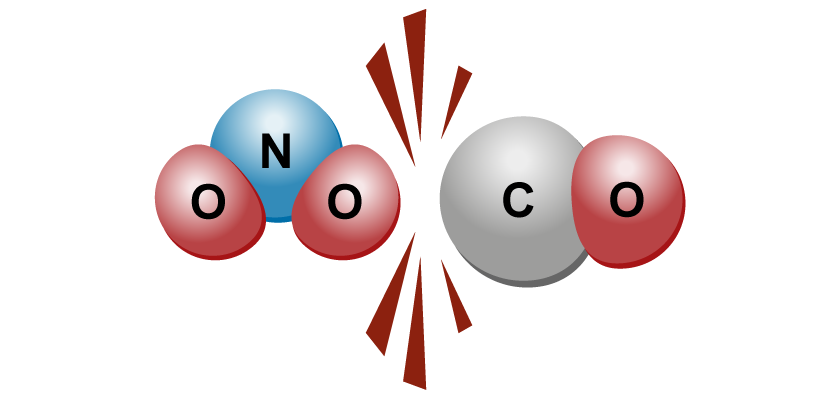 |
Koonti kemiallisista reaktioista
Seuraavaan taulukkoon on koottu kemiallisia reaktioita perusjaon, epäorgaanisen kemian ja orgaanisen kemian reaktioiden mukaan. Tarkemmat reaktiomekanismit ja reaktio-olosuhteet on esitelty reaktiokohtaisesti alaluvuissa.
Erilaisia kemiallisia reaktioita
Reaktio | Epäorgaaninen kemia | Orgaaninen kemia |
Happo-emäsreaktiot, protoninsiirtoreaktiot ja neutraloitumisreaktiot | Happo-emäsreaktiossa hapot luovuttavat protonin ja emäkset vastaanottavat protonin (1). Neutraloitumisreaktiossa hapon ja emäksen reaktiossa syntyy lähes aina suolaa ja vettä. | Happoina toimivat molekyylit, joissa on hapan funktionaalinen ryhmä, esim. karboksyylihappo- ja fenoliryhmä. Mistä johtui fenolien happamuus? Selvitä. Aminoryhmä taas on emäksinen funktionaalinen ryhmä. |
Palamisreaktiot | Palamisreaktio on reaktio aineen hapen kanssa. Reaktiossa muodostuu oksideja. | Hiiliyhdisteiden palaessa syntyy hiilidioksidia (epätäydellisessä palamisessa hiilimonoksidia), vettä ja muiden aineiden oksideja (mm. typpioksideja). |
Hapetus-pelkistysreaktiot | Kun atomi luovuttaa elektronin, se hapettuu. Kun atomi vastaanottaa elektronin, se pelkistyy. Hapetus-pelkistysreaktiossa tapahtuvat molemmat. Reaktiota kutsutaan myös hapettumis-pelkistymisreaktioksi. Näissä tapahtuu reagoivien aineiden hapetuslukujen muutoksia eli elektronien siirtymisiä. | Orgaanisten aineiden kuten alkoholien ja karbonyyliyhdisteiden hapetus- ja pelkistysreaktioita ovat seuraavat: HAPETTUMINEN
PELKISTYMINEN on em. reaktioiden käänteisreaktioita. |
Saostumisreaktiot, | Saostumisreaktio on esim. NaSO4 (aq) + BaCl2 (aq) → BaSO4 (s) + NaCl (aq); jossa muut aineet ovat veteen liukenevia, paitsi BaSO4, joka on niukkaliukoinen. Tämän näkee (s)-merkinnästä. Em. reaktiota voidaan kutsua myös ioninvaihtoreaktioksi, jossa Na- ja Ba-atomit "vaihtavat" niihin liittyneitä anioneja. Näitä reaktioita käytetään epäorgaanisessa kemiassa ionien tunnistukseen. Reaktiossa syntyy tietyn värisiä yhdisteitä. | Orgaanisessa kemiassa tunnistusreaktioita ovat funktionaalisten ryhmien aiheuttamat reaktiot. Nämä ovat kuitenkin pääosin aina omia reaktioryhmiä, kuten esim. additioreaktiot tässä kirjassa. |
Kondensaatio ja hydrolyysireaktiot | Myös happo-emäsreaktiot ovat kondensaatioreaktioita. | Kondensoitumisessa kaksi molekyyliä liittyy yhteen ja liittymäkohdasta lohkeaa eli kondensoituu pois pieni molekyyli. Lohkeava molekyyli on yleensä vesimolekyyli. Kondensaatioreaktioita ovat mm.: esteröityminen, eetterin muodostuminen, amidin muodostuminen ja peptidisidoksen muodostuminen. Jatkuvaa kondensaatioreaktiota, joka tuottaa jatkuvasti pidempää ketjua, kutsutaan polykondensaatioksi. Hydrolyysi on kondensaation käänteinen reaktio. |
Hajoamisreaktiot | Esim. karbonaattien hajoaminen hiilidioksidiksi ja metallioksideiksi. | Krakkaus eli pitkien hiiliketjujen pilkkominen. |
Kompleksin muodostusreaktiot | Reaktiossa syntyy yhdiste, joka muodostuu keskusatomista ja siihen koordinaatiosidoksin kiinnittyneistä ligandeista. Keskusatomi on yleensä jokin siirtymämetalli-ioni. | Kelaattien muodostuminen on rinnasteinen kompleksien muodostumiseen. Kelaatit ovat yleensä isompia orgaanisia yhdisteitä, jotka pystyvät sitomaan useammalla sidoksella yhden metalliatomin muodostaen rengasmaisen rakenteen. |
Substituutio- eli korvautumisreaktiot | Substituutioreaktioita ovat mm. nitraus (reaktio typpihapon kanssa), sulfonointi (reaktio rikkihapon kanssa) ja halogenointi Substituutioreaktio tapahtuu myös aromaattisilla yhdisteillä, kun esim. bentseenirenkaan vetyjä korvataan toisilla alkuaineilla. | |
Additio- eli liittymisreaktiot | Additioreaktio kohdistuu kaksois- ja kolmoissidoksiin. Tyypillinen additioreaktio on mm. hydraus, jossa yhdisteeseen liitetään vetyä. | |
Eliminaatioreaktiot | Eliminaatioreaktiossa syntyy kaksoissidoksellisia yhdisteitä. Reaktiossa irrotetaan usein vettä. |
Nämä määritelmät perustuvat Brønstedtin happo-emästeoriaan. Vertaa Brønstedtin teoriaa Arrheniuksen määritelmään, joka toimii ainoastaan vesiliuoksissa, tai Lewisin määritelmään, joka toimii laajemmassakin yhteydessä. Lewisin määritelmässä emäs luovuttaa elektroniparin ja happo vastaanottaa sen. Määritelmä on käytössä esimerkiksi kompleksiyhdisteiden syntymisen yhteydessä.
Testaa tietosi
1. Kemiallisen reaktion keskeinen tunnuspiirre on, että
- liuoksen väri muuttuu.
- aineen rakenne muuttuu.
- lämpötila muuttuu.
2. Kemiallisen reaktion tuote on lähtöainetta
- epästabiilimpi.
- raskaampi.
- pysyvämpi.
3. Reaktiot tapahtuvat vain, jos rakenneosat törmäävät toisiinsa oikealla nopeudella oikeassa kulmassa. Reaktiota voidaan nopeuttaa lisäämällä suotuisten törmäysten todennäköisyyttä. Tämä saadaan aikaiseksi esim.
- kuumentamalla reaktioseosta.
- jäähdyttämällä reaktioseosta.
- sekoittamalla reaktioseosta.
4. Aineen ja energian häviämättömyyden lain mukaan
- ainetta tai energiaa ei voi luoda tyhjästä eikä hävittää.
- kemiallisessa reaktiossa syntyy energiaa.
- kemiallisessa reaktiossa syntyy usein enemmän ainetta kuin on lähtöaineita.
5. Molekyylien lämpöliike voidaan lopettaa jäähdyttämällä systeemin lämpötila riittävän alhaiseksi.
- Kyllä
- Ei