Alkaanien rakenne ja luokittelu
Alkaanissa on hiilten välillä ainoastaan yksinkertaisia sidoksia, minkä vuoksi niitä nimitetään myös tyydyttyneiksi hiilivedyiksi. Rakenteeltaan alkaanin hiiliketju voi olla suora, haaroittunut tai rengas. Haaroittuneessa hiilivedyssä runkoon on liittynyt yksi tai useampi sivuketju. Sivuketju voi olla yhden tai useamman hiilen mittainen. Rengasmaisia hiilivetyjä kutsutaan syklisiksi hiilivedyiksi.
Alkaanit muodostavat homologisen sarjan, jossa yhdisteen kemiallinen kaava[käsite: kaava, kemisk formel, chemical formula – Kaava on kemiallisten merkkien merkintätapa, joka kuvaa aineen koostumusta.] on muotoa CnH2n+2 (n = 1, 2, 3...). Esimerkiksi lukuarvolla n = 1 muodostuu yhdiste, jonka kaava on C1H4. Alaindeksi 1 jätetään yleensä merkitsemättä. Näin muodostettua molekyyliä nimitetään metaaniksi. Lukuarvolla n = 2 muodostuu C2H6, jota nimitetään etaaniksi ja niin edelleen. Syklisten alkaanien homologisen sarjan yleinen esitysmuoto on vastaavasti CnH2n.
Hiilivetyjen rakennetta voidaan kuvata monella eri tavalla. Erityisesti suuret molekyylit piirretään usein viivakaavoina[käsite: viivakaava, skelettformel, line structure/segment – Viivakaava on yksinkertaistettu rakennekaava, jossa hiilirunko on kuvattu viivana ja vain funktionaaliset ryhmät kemiallisilla merkeillä. ] (oikealla).
Alkaaneja
Nimi | Rakennekaava | Kemiallinen kaava | Viivakaava |
Metaani | CH4 | CH4 | |
Etaani | CH3CH3 | ||
Propaani | CH3CH2CH3 | ||
Butaani | CH3CH2CH2H3 | ||
Pentaani | CH3CH2CH2CH2H3 | ||
Heksaani | CH3CH2CH2CH2CH2H3 |
MarvinSketch-tiedosto: alkaaneja.mrv
Alkaanien ominaisuuksia
Hiiliketjun pituus vaikuttaa molekyylien välisiin vuorovaikutusvoimiin. Alkaanien sulamis[käsite: sulamispiste, smältpunkt, melting point – Lämpötila, jossa kiinteä aine muuttuu nesteeksi eli sulaa. ]- ja kiehumispisteet kasvavat koon kasvaessa. Mitä pidempi hiiliketju, sitä enemmän vuorovaikutuksia molekyylien välillä esiintyy. Tästä johtuen lyhytketjuisten alkaanien välillä on vähän heikkoja vuorovaikutuksia[käsite: heikko sidos, svaga bindning, weak bond / intermolecular force – Heikko sidos on molekyylien välinen heikko sidos (molekyylien välinen heikko vuorovaikutus).], ja ne ovat huoneen lämpötilassa kaasuja. Keskimittaisten välillä vuorovaikutuksia on enemmän ja ne ovat nesteitä. Pitkäketjuisten alkaanien välillä vuorovaikutuksia on eniten ja ne ovat kiinteitä. Esim. metaani on huoneen lämpötilassa kaasu (1 hiili), bensan pääaineosa oktaani neste (8 hiiltä) ja parafiinivaha kiinteä (20 hiiltä).
Alkaanit ovat heikosti poolisia[käsite: poolinen, polär, polar – Poolinen molekyyli on molekyyli, jossa kovalenttisen sidoksen elektronipari ei jakaudu kahden atomin välillä täysin tasan, ja molekyylissä on positiivisia ja negatiivisia osittaisvarauksia.] tai poolittomia[käsite: pooliton, opolär, nonpolar – Pooliton molekyyli on molekyyli, jossa ei ole osittaisvarauksia tai ne kumoavat toisensa sen rakenteen vuoksi.] yhdisteitä. Hiilen ja vedyn välinen sidos on heikosti poolinen, joten molekyyli voi olla poolinen. Poolisuus voi kuitenkin kumoutua, jos molekyylin rakenne on symmetrinen. Poolittomat ja heikosti pooliset alkaanit liukenevat poolittomiin liuottimiin kuten bensiiniin, mutta huonosti poolisiin liuottimiin kuten veteen. Nestemäisiä alkaaneja esim. heksaania (C6H14), käytetään liuottimina muille poolittomille aineille.
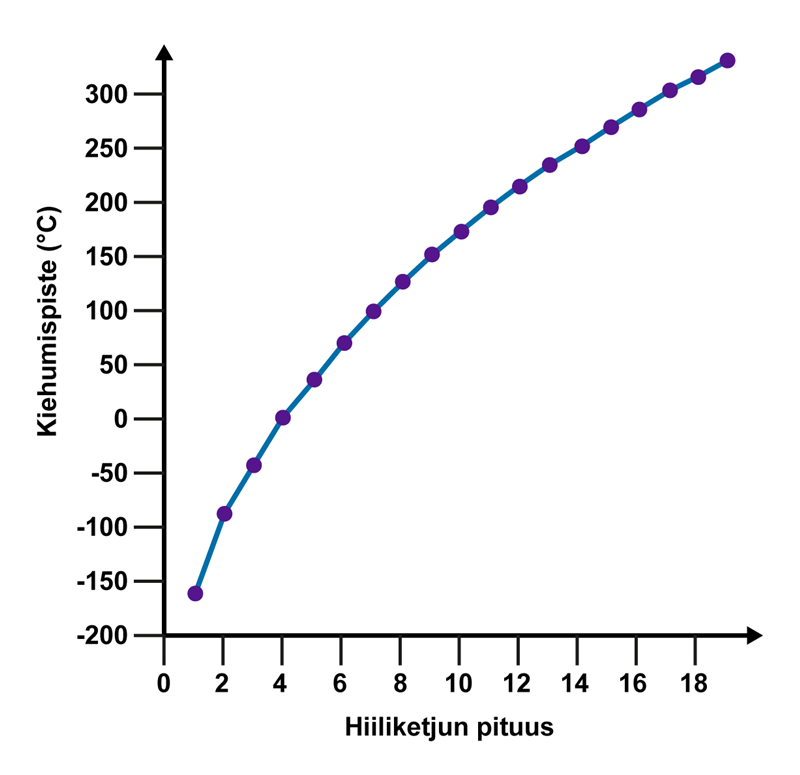
Seuraavassa taulukossa voi vertailla molekyylejä (hiiliketjun pituuden mukaan) ja yhdisteiden kiehumispisteitä[käsite: kiehumispiste, kokpunkt, boiling point – Kiehumispisteessä neste muuttuu kaasuksi ja alkaa kiehua.].
Alkaanien ominaisuuksia
Molekyylin nimi | Kemiallinen kaava | Sulamispiste (°C) | Kiehumispiste (°C) | Tiheys (20°C) | Olomuoto |
Metaani | CH4 | –184 | –164 | 0,668 g/l | Kaasu |
Etaani | C2H6 | –183 | –89 | 1,265 g/l | Kaasu |
Propaani | C3H8 | –190 | –42 | 1,867 g/l | Kaasu |
Butaani | C4H10 | –138 | –1 | 2,493 g/l | Kaasu |
Pentaani | C5H12 | –130 | 36 | 0,626 g/ml | Neste |
Heksaani | C6H14 | –95 | 69 | 0,659 g/ml | Neste |
Oktaani | C8H18 | –57 | 125 | 0,703 g/ml | Neste |
Dekaani | C10H22 | –30 | 174 | 0,730 g/ml | Neste |
Elinympäristön alkaaneja
Alkaaneilla on vain vähän merkitystä biologisille systeemeille, mutta suuri merkitys yhteiskunnalle. Kaikki alkaanit ovat värittömiä ja tuoksuvat joko hyvin miedosti tai eivät ollenkaan. Alkaanien reaktiivisuus on melko vähäistä, mutta arkielämässä niille on käyttöä polttoaineina. Monet energianlähteenä käytettävät hiilivedyt ovat molekyylikooltaan pienikokoisia alkaaneja. Tyypillisiä ovat kotitalouksissa käytetty maakaasu (mentaania CH4) ja sytyttimissä käytetty nestekaasu (pääasiassa propaania C3H8 ja butaania C4H10). Maakaasu on ilmaa kevyempää, joten se kohoaa ylöspäin ja voi kerrostua esim. huoneistoissa lähelle katonrajaa. Huoneistojen poistoilmaventtiilit sijaitsevat yleensä katonrajassa, mikä auttaa poistamaan kaasua, mutta poistumista voi tehostaa tuulettamalla ja ilmaa liikuttamalla. Nestekaasun tiheys on sen sijaan ilmaa suurempi, joten se valuu alaspäin ja kerrostuu lattioille. Lattialle kerrostuva maakaasu on alttiina lämmön ja kipinänlähteille, joten tehokas kaasun tuulettaminen pitää aloittaa heti, kun vuodon havaitsee.
Alkaanit liukenevat veteen huonosti ja niiden tiheys on pienempi kuin vedellä. Tämän seurauksena alkaanit kerrostuvat veden pinnalle, mistä voi seurata monenlaisia ympäristöongelmia. Vesistöön päässyt öljy kerrostuu veden pinnalle ja kerääntyy rannikoille, missä se aiheuttaa monenlaista haittaa vesistöjen eläimistölle, kuten linnuille ja nisäkkäille. Alkaaneja esiintyy esim. suo- ja maakaasussa, jotka ovat pääasiassa metaania. Butaania käytetään paineistettuna nestekaasuna sytyttimissä ja retkikeittimissä.
- Dekaani
- Metaani
- Pentaani
- Etaani

