Alkuaineet
Alkuaineella[käsite: alkuaine, grundämne, chemical element – Alkuaine on aine, jonka jokaisessa atomissa on sama määrä protoneja.] tarkoitetaan atomia, jonka ytimessä on tietty määrä protoneja ja jota ei voida kemiallisella menetelmällä jakaa pienempiin osiin. Alkuainetta ei myöskään voida kemiallisella tekniikalla muuttaa toiseksi alkuaineeksi.
Alkuaineiden määrä on rajallinen. Tällä hetkellä tunnetaan n. 120 eri alkuainetta. Uusimmat ja samalla raskaimmat alkuaineet on valmistettu laboratoriossa. Ihmisen rakentamiseen riittää parikymmentä eri alkuainetta. Monien käyttötavaroiden rakentamiseen riittää huomattavasti vähäisempi määrä alkuaineita. Esimerkiksi monet muovit rakentuvat vain kahdesta alkuaineesta, hiilestä ja vedystä.

Alkuaineen perusrakenneyksikkö on yleensä atomi. Poikkeuksen tähän tekevät muutamat normaaleissa olosuhteissa kaasumaisina esiintyvät alkuaineet kuten vety, typpi, happi ja kloori. Nämä alkuaineet esiintyvät kahden atomin muodostamina molekyyleinä.
Jotkin normaaleissa olosuhteissa kiinteänä esiintyvät alkuaineet kuten hiili, fosfori, rikki ja tina esiintyvät useamman alkuaineatomin muodostamina rakenteina. Ilmiöstä käytetään nimitystä allotropia[käsite: allotropia, allotropi, allotropy – Allotropia on alkuaineiden kyky esiintyä samassa paineessa ja lämpötilassa erilaisissa kemiallisissa muodoissa.]. Varsinkin hiilen eri rakennemuodoilla kuten grafiitilla, timantilla ja fullereenillä on merkittäviä eroja niiden fysikaalisissa ja kemiallisissa ominaisuuksissa.
Isotoopit
Atomit, joissa on yhtä monta protonia, mutta eri määrä neutroneja ovat toistensa isotooppeja[käsite: isotooppi, isotop, isotope – Isotooppi on alkuaineen atomi, jolla on tietty määrä neutroneja.]. Atomin ytimessä olevien protonien lukumäärän määrää atomin laadun, ja neutronien lukumäärä sen isotoopin laadun. Isotopia tarkoittaa sitä, että saman alkuaineen atomien ytimissä esiintyy vaihtelua neutronien lukumäärissä. Perusmuodossa vetyatomi rakentuu yhden protonin muodostamasta ytimestä ja sitä kiertävästä elektronista. Ytimessä voi kuitenkin olla protonin lisäksi yksi tai kaksi neutronia. Neutronit ovat varauksettomia, joten ne eivät vaikuta elektronien lukumäärään, eivätkä atomin kemiallisiin ominaisuuksiin.

Isotopiailmiötä hyödynnetään mm. fysiikan, kemian, biologian, lääketieteen ja arkeologian tutkimuksessa. Esimerkiksi ydinvoimaloissa tavallisen veden sijaan käytetään niin sanottua raskasta vettä, jossa vety on korvattu deuteriumilla. Isotooppien perusteella voidaan selvittää, mitkä alkuaineet reagoivat milläkin tavoin kemiallisissa reaktioissa. Lääketieteellisessä kuvantamisessa ja sairauksien hoidossa hyödynnetään isotooppeja. Arkeologisessa tutkimuksessa iänmääritys perustuu hiilen isotoopin hiili-14 radioaktiiviseen hajoamiseen.
Alkuaineen kemiallinen merkki
Alkuaineet kuvattiin aluksi keksityin tai muista yhteyksistä johdetuin symbolein. Tästä ovat peräisin esimerkiksi kullan ⊙, hopean ☽, kuparin ♀ ja raudan ♂ tunnusomaiset merkinnät.

Nykyisen symbolikielen kehittäjänä pidetään ruotsalaista kemistiä Jöns Jakob Berzeliusta (1779–1848). Uudistuksen johdosta kemiallisesta symboliikasta katosi alkemistien mystisyys, ja kemian kieli sai yhtenäisemmän rakenteen. Esimerkiksi kultaa ilmaistaan lyhenteellä Au ja hopeaa lyhenteellä Ag, jotka ovat sanojen ”aurum” ja ”argentum” lyhenteitä.
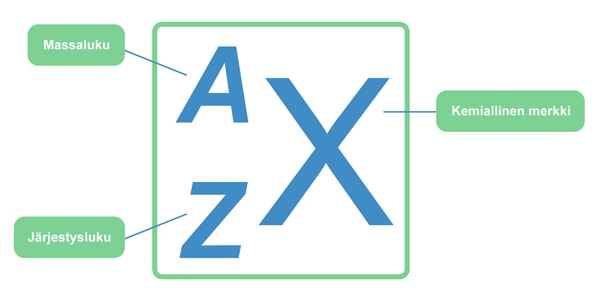
Alkuaineen järjestysluku[käsite: järjestysluku, atomnummer, atomic number – Järjestysluku (Z) on alkuaineen atomeissa esiintyvien protonien lukumäärä.] Z määräytyy ytimessä olevien protonien lukumäärän perusteella. Vedyn järjestysluku on yksi, koska sen ytimessä on yksi protoni, ja heliumin vastaavasti kaksi. Järjestysluku ilmoitetaan alkuaineen kemiallisen merkin edessä alaindeksinä. Esimerkiksi vedyn merkintä on 1H.
Alkuaineen massaluku[käsite: massaluku, masstal, mass number – Massaluku (A) on atomin protonien ja neutronien lukumäärien summa.] A on ytimessä olevien protonien ja neutronien yhteenlaskettu lukumäärä. Se merkitään alkuaineen kemiallisen merkin eteen yläindeksiksi 1H. Järjestysluku ja massaluku voidaan ilmoittaa myös yhtä aikaa: .
Atomista tulee ioni[käsite: ioni, jon, ion – Ioni on sähköisesti varautunut atomi (esim. Ca2+) tai atomiryhmä (esim. NH4+). Se on luovuttanut tai vastaanottanut elektroneja ja saanut siten sähköisen varauksen.], kun se vastaanottaa tai luovuttaa elektroneja. Positiivisesti varautuneessa ionissa on elektronivajaus, jota merkitään +-merkillä, ja se sijoitetaan kemiallisen merkin jälkeen yläindeksiksi. Positiivisesti varautuneen vetyionin merkintä on H+.
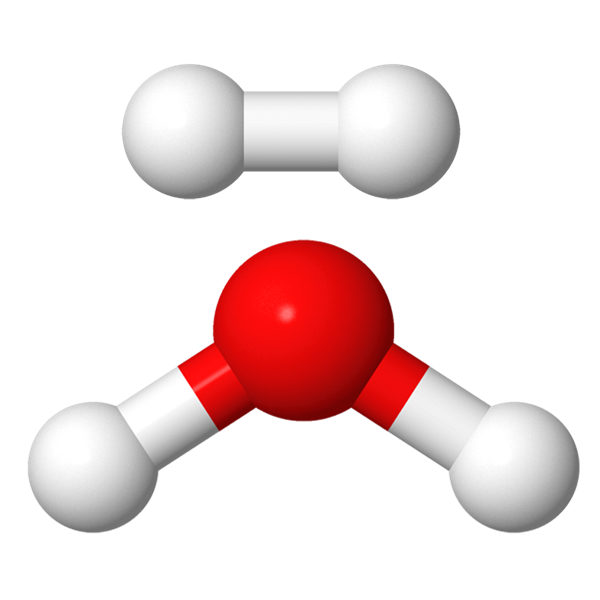
Alkuaine voi rakentua kahdesta tai useammasta saman alkuaineen atomista. Esimerkiksi vety esiintyy kahden vetyatomin muodostamana molekyylinä[käsite: molekyyli, molekyl, molecule – Molekyyli on kahden tai useamman kovalenttisesti sitoutuneen atomin muodostama sähköisesti neutraali ryhmä. Molekyylien muodostamaa yhdistettä kutsutaan molekyyliyhdisteeksi.]. Hiili voi esiintyä monien hiiliatomien muodostamana pitkänä ketjuna. Alkuaineessa esiintyvien saman lajin atomien lukumäärä ilmoitetaan kemiallisen merkin jälkeen alaindeksinä. Vetyatomia kuvaava merkintä on H, mutta vetymolekyylin merkintä on H2.
Yhdisteessä olevan saman alkuaineen lukumäärä ilmoitetaan kemiallisen merkin jälkeen alaindeksiin merkityllä numerolla. Esimerkiksi vesimolekyylin kaava H2O tarkoittaa sitä, että molekyyli rakentuu kahdesta vetyatomista ja yhdestä happiatomista. Alaindeksi yksi jätetään yleensä merkitsemättä.
Saman alkuaineen eri isotoopit erotetaan toisistaan massaluvun perusteella. Esimerkiksi vedyn isotoopeista käytetään nimiä vety-1, vety-2 ja vety-3 ja niitä merkitään joko 1H, 2H ja 3H tai , ja . Vedyn raskaammilla isotoopeilla on omat vakiintuneet nimensä, on deuterium ja tritium.
Testaa tietosi
a) Alkuaineella tarkoitetaan atomia, jonka ytimessä on tietty määrä protoneja ja jota ei voida kemiallisella menetelmällä jakaa pienempiin osiin, eikä muuttaa toiseksi aineeksi.
- Oikein
- Väärin
b) Tällä hetkellä tunnetaan 150 alkuainetta.
- Oikein
- Väärin
c) Alkuaineita löytyy luonnosta, mutta niitä voidaan valmistaa myös laboratoriossa.
- Oikein
- Väärin
d) Alkuaineen perusrakenneyksikkö on aina atomi.
- Oikein
- Väärin
e) Massaluku (A) ilmaisee atomin ytimen protonien ja elektronien yhteenlasketun lukumäärän.
- Oikein
- Väärin
f) Järjestysluku (Z) ilmaisee atomin ytimen protonien määrän.
- Oikein
- Väärin
g) Positiivisesti varautuneessa ionissa on elektronivajaus.
- Oikein
- Väärin
h) Vetymolekyyli rakentuu kahdesta vetyatomista.
- Oikein
- Väärin
i) Kemiallinen yhdiste koostuu kahdesta tai useammasta alkuaineesta.
- Oikein
- Väärin
j) Atomeja, joissa on yhtä monta protonia, mutta eri määrä neutroneja kutsutaan toistensa isotoopeiksi.
- Oikein
- Väärin
a) Isotoopeilla on sama määrä protoneja, mutta eri määrä neutroneja.
- Kyllä
- Ei
b) Neutronien määrän muutos muuttaa atomin kemiallisia ominaisuuksia.
- Kyllä
- Ei
c) Radioaktiivinen hajoaminen voi johtaa siihen, että atomin massaluku ja järjestysluku muuttuvat.
- Kyllä
- Ei
d) Vedyllä on kolme isotooppia, 1H, 2H ja 3H.
- Kyllä
- Ei
e) Isotopiailmiön radioaktiivista hajoamista hyödynnetään mm. arkeologisissa tutkimuksissa.
- Kyllä
- Ei
