Atomi- ja molekyylimalleilla visualisoidaan silmin havaitsematonta maailmaa
Atomit ja molekyylit[käsite: molekyyli, molekyl, molecule – Molekyyli on kahden tai useamman kovalenttisesti sitoutuneen atomin muodostama sähköisesti neutraali ryhmä. Molekyylien muodostamaa yhdistettä kutsutaan molekyyliyhdisteeksi.] ovat niin pieniä, että niitä ei voi nähdä paljaalla silmällä. Tämän vuoksi molekyylejä kuvataan malleilla. Erilaisia 3D-malleja tarvitaan, koska jokainen mallityyppi sisältää erilaista tietoa. Tavoitteena on korostaa tarkastelun kohteena olevia yksityiskohtia. Tyypillinen molekyylimalli on esimerkiksi pallotikkumalli. Se antaa tietoa atomeista, niiden sijainnista ja molekyylin sidostyypeistä. Viivakaavamallissa piirretään vain atomien väliset sidokset. Atomien laatu pitää päätellä itse. Kalottimalli antaa katsojalle tietoa molekyylin koosta ja geometrisestä muodosta. Toisinaan molekyyli piirretään kaksiulotteisena rakennekaavana. 2D-malli vastaa todellisuutta huonommin kuin vastaava 3D-malli, mutta voi olla visuaalisesti helpommin hahmotettavissa.
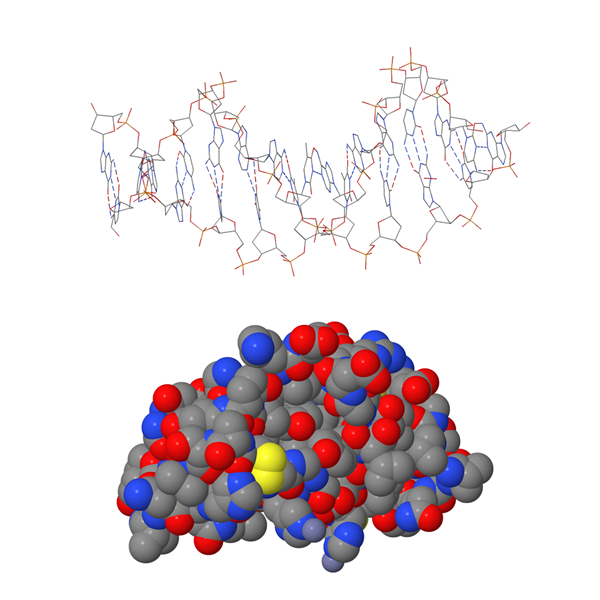
Yleisimmät rakennemallit
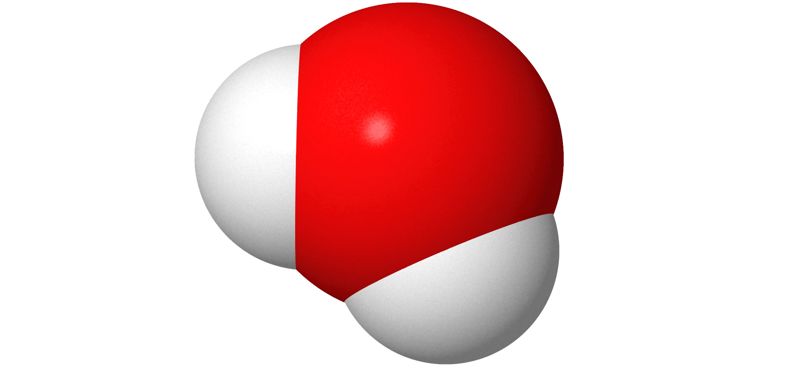
Kalottimallissa atomit ja niiden paikat kuvataan toisiinsa upotettujen eriväristen pallojen avulla. Atomit esitetään eri väreillä, jotta ne voitaisiin tunnistaa helpommin. Todellisuudessa atomit eivät ole minkään värisiä. Eri alkuaineen atomit kuvataan erikokoisilla palloilla. Pallon koko perustuu laskennalliseen kemiaan.
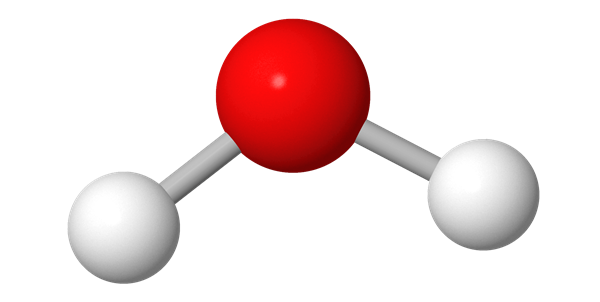
Pallotikkumallissa pallot ovat samankokoisia kuin kalottimallissa, mutta atomien välinen etäisyys on suurempi. Atomeja yhdistävä viiva kuvaa atomien välistä sähköistä vuorovaikutusta eli sidosta. Sidosviivojen suunta, pituus ja niiden väliset kulmat perustuvat laskennalliseen kemiaan. Pallotikkumalli näyttää molekyylin kolmiulotteisen rakenteen kalottimallia selkeämmin.
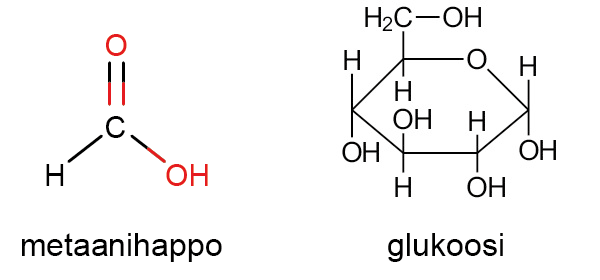
Rakennekaava[käsite: rakennekaava, strukturformel, structural formula – Rakennekaava kuvaa miten molekyylin atomit ovat sitoutuneet toisiinsa ja sen avaruudellisen rakenteen.] ilmoittaa molekyylissä olevien atomien laadun ja määrän, atomeja yhdistävien sidosten laadun ja rakenteen geometrian. Atomit merkitään niiden kemiallisilla merkeillä ja atomien väliset sidokset sidosviivoilla. Sidosviivojen väliset kulmat voivat olla todelliset tai piirrosteknisistä syistä yksinkertaistettuja ja suurpiirteisiä.
Tiivistetty rakennekaava[käsite: tiivistetty rakennekaava, summaformel, condensed structural formula – Tiivistetty rakennekaava on rakennekaava, jossa esim. kaikkia sidoksia ei ole merkitty näkyviin.] ilmoittaa molekyylin rakenteen samalla tarkkuudella kuin rakennekaava, mutta jotkin sidosviivoista jätetään merkitsemättä. Esimerkiksi etanoli merkitään CH3 – CH2 – OH tai vielä lyhyemmin CH3CH2OH.
Viivakaava[käsite: viivakaava, skelettformel, line structure/segment – Viivakaava on yksinkertaistettu rakennekaava, jossa hiilirunko on kuvattu viivana ja vain funktionaaliset ryhmät kemiallisilla merkeillä.] on rakennekaavamallien yksinkertaistetuin esitysmuoto. Hiili- ja vetyatomien symbolit jätetään merkitsemättä. Hiiliatomit sijaitsevat viivan päissä, kulmissa ja haarautumiskohdissa. Jokainen tällainen kohta käsittää myös sen verran vetyatomeja, joita kyseiseen hiileen voi enintään liittyä. Hiilivetyketjuun liittyneet vierasatomit ja toiminnalliset ryhmät merkitään näkyviin niitä vastaavilla kemiallisilla merkeillä, samoin muihin kuin hiiliatomiin sitoutuneet vetyatomit merkitään näkyviin.
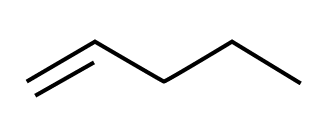
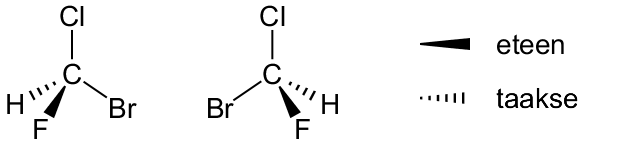
Kolmiulotteinen rakennekaava on rakennekaavan visuaalisempi muoto. Se kuvaa atomien keskinäiset paikat pallotikku- tai kalottimallia vastaavalla tavalla. Kolmiulotteista rakennekaavaa käytetään erityisesti silloin, kun rakennekaavassa halutaan korostaa yhdisteen geometriaa. Tällä on erityinen merkitys rakenne- eli konstituutioisomeriassa ja avaruus- eli stereoisomeriassa.
Suhdekaava ilmoittaa yhdisteen alkuaineiden lukumäärien suhteen. Esimerkiksi ruokasuolan suhdekaava on NaCl, mikä tarkoittaa sitä, että natriumia ja kloridia on yhdisteessä suhteessa 1:1. Glukoosissa C6H12O6 hiiltä, vetyä ja happea on suhteessa 1:2:1, joten sen suhdekaava on (CH2O)6. Toisinaan suhdekaava on sama kuin yhdisteen molekyylikaava. Esimerkiksi veden kaava H2O on samalla sekä suhdekaava että molekyylikaava. Suhdekaavasta käytetään myös nimitystä bruttokaava.
Suhdekaavassa alaindeksit ilmoittavat yhdessä molekyylissä tai kaavayksikössä olevien atomien keskinäiset lukumääräsuhteet. Eri yhdisteillä voi olla sama suhdekaava, mutta eri molekyylikaava. Esimerkiksi formaldehydillä CH2O ja glukoosilla (CH2O)x on sama suhdekaava. Glukoosimolekyylissä alkuaineiden todelliset määrät[käsite: ainemäärä, substansmängd, chemical amount tai amount of substance – Ainemäärä on SI-järjestelmän perussuure. Ainemäärän tunnus on n ja yksikkö on mooli, mol.] ovat kuitenkin kuusinkertaiset formaldehydiin verrattuna (CH2O)6. Suhdekaavan avulla voidaan määrittää alkuaineiden massasuhteita ja massaprosenttisia osuuksia.
Empiirinen kaava tarkoittaa samaa kuin suhdekaava samalla korostaen, että yhdisteen kemiallinen koostumus on määritetty kokeellisesti. Mittausten perusteella tiedetään alkuaineiden laatu ja niiden suhteellinen määrä, muttei atomien paikkoja tai sidostyyppejä. Esimerkiksi etaanin C2H6 empiirinen kaava on CH3 tai tarkemmin (CH3)x. Kun x:n arvo saadaan selville, voidaan ratkaista yhdisteen tarkka suhde-, molekyyli- ja rakennekaava.
Molekyylikaava ilmoittaa yhdisteen sisältämien alkuaineiden atomien lajit ja todelliset lukumäärät sekä mahdollisesti myös toiminnallisen ryhmän. Esimerkiksi etanolin molekyylikaava on C2H5OH, joka korostaa molekyylissä olevan OH-ryhmä. Glukoosin molekyylikaava on C6H12O6, mutta tämä ei kerro, että yhdisteessä on monta OH-ryhmää.
Ionikaava ilmoittaa hiukkasen varauksen. Yksittäiset atomit, atomiryhmät ja molekyylit voivat esiintyä varauksellisina ioneina. Esimerkiksi vesimolekyylin kaava on H2O, mutta ionisoituessa siitä muodostuu joko oksoniumioni H3O+ tai hydroksidi-ioni OH–.
Elektronirakenteiden havainnollistamiseen käytetään myös monia eri malleja. Lewisin mallissa alkuaineen kemiallisen merkin viereen merkitään ulkoelektronit[käsite: ulkoelektronit, valenselektron, valence electron – Ulkoelektronit sijaitsevat alkuaineen korkeimmalla energiatasolla. Ne määräävät atomin kemialliset ominaisuudet (esim. reaktiivisuus).] pisteinä. Pariutuneet elektronit merkitään kahdella vierekkäisellä pisteellä.
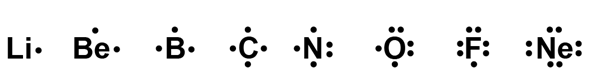
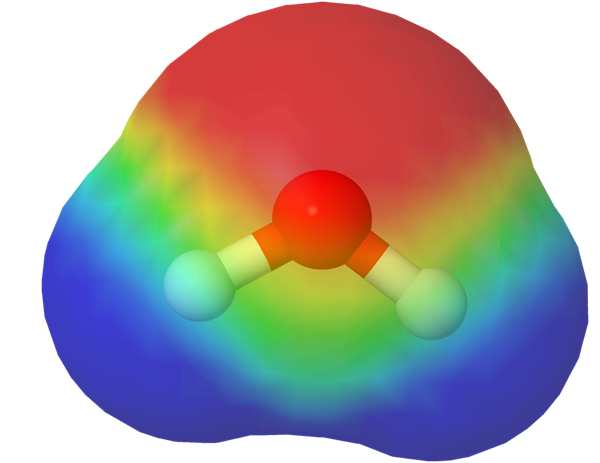
Varausjakaumamalli havainnollistaa sähkövarausten jakautumisen molekyylin eri osissa. Varausjakaumamallit perustuvat laskennalliseen kemiaan.
Mikä malli valitaan?
Tilanne ratkaisee, mikä malli on tarkoituksenmukaisin. Oikean mallin valitseminen on kemistin ammattitaitoa. Mikään malli ei vastaa täysin todellisuutta, koska molekyylin muoto muuttuu lämpövärähtelyn vuoksi.
MarvinSketch-tiedosto: metaanihappo.mrv
Aineen pakkautumista visualisoidaan hilarakenteilla
Aineen rakenteen määrittävät hilatyypit ovat ionihila, kovalenttinen hila, atomihila, metallihila ja molekyylihila. Hilatyypin määrää sidos, jonka avulla aine pysyy koossa. Erilaiset hilarakenteet antavat aineille erilaisia fysikaalisia ja kemiallisia ominaisuuksia. Esimerkiksi ioni-, kovalenttisen ja atomihilan omaavat materiaalit ovat kovia, ja niiden sulamispiste on korkea. Metallihilaisilla aineilla kovuus, sulamispiste ja kiehumispiste vaihtelevat suuresti. Molekyylihilaiset aineet ovat pehmeitä, ja niiden sulamispiste on matala.
Ionihila perustuu ionisidoksiin, jonka rikkomisen seurauksena aine sulaa. Jäähtyessä aine kiinteytyy, ja hila muodostuu uudestaan. Kovalenttinen hila ja atomihila perustuvat kovalenttiseen sidokseen[käsite: kovalenttinen sidos, kovalent bindning, covalent bond – Kovalenttinen sidos on vahva sidos, joka liittää atomit toisiinsa yhteisellä elektroniparilla. Se voi olla yksin-, kaksin- tai kolminkertainen riippuen elektroniparien lukumäärästä.]. Esimerkiksi piidioksidissa jokainen pii- ja happiatomi on kovalenttisesti sitoutunut muihin atomin ympärillä oleviin atomeihin. Rakenne on joka suuntaan jatkuva, eikä erillisiä SiO2-molekyylejä voi erottaa – kaikki sidospituudet[käsite: sidospituus, bindningslängden, bond length – Samanmerkkisesti varautuneet elektronit ja ytimet kohdistavat toisiinsa poistovoiman. Veto- ja poistovoimista johtuvaa ydinten välistä tasapainoetäisyyttä nimitetään sidospituudeksi.] (Si–O) ovat samoja. Timantti puolestaan rakentuu hiiliatomien muodostamasta atomihilasta, joka on erittäin luja. Jokainen hiiliatomi sitoutuu kovalenttisesti neljään muuhun hiiliatomiin. Metallihila perustuu metallisidokseen. Metallihilan erityisiä ominaisuuksia on elektronien vapaa liike, joka tekee metalleista sähkönjohtavia. Molekyylihila perustuu molekyylien välisiin heikkoihin sidoksiin[käsite: heikko sidos, svaga bindning, weak bond – Heikot sidokset ovat molekyylien välisiä heikkoja vuorovaikutuksia.]. Esimerkiksi jää pysyy koossa vesimolekyylien välisten vetysidoksien ansiosta. Kiteen kuusikulmainen rakenne määräytyy vesimolekyylissä olevien happi- ja vetyatomien sidoskulmien perusteella.
Kiinteiden aineiden hilarakenteiden vertailu
Atomihila | Pooliton molekyylihila | Poolinen molekyylihila | Ionihila | Metallihila | |
Rakenne kiinteänä | 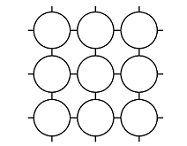 | 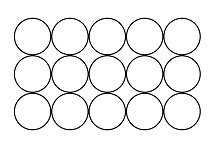 | 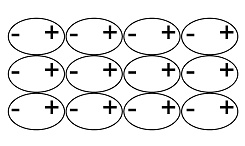 | 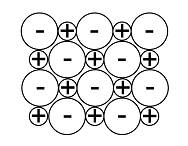 | 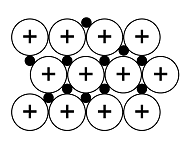 |
Rakenneosat | atomit | poolittomat molekyylit | pooliset molekyylit | positiiviset ja negatiiviset ionit | metalli-ionit ja sidoselektronit |
Rakenneosien välinen sidos | kovalenttinen sidos | dispersiovoima | dipoli-dipolisidos (erikoistapauksena vetysidos) | ionisidos | metallisidos |
Sitoutuneet alkuaineet | yleensä ryhmän 14 alkuaineet | epämetalli ja epämetalli | yleensä epämetalli ja epämetalli | metalli ja epämetalli | metalli |
Esimerkkiaine | Si, C, SiC | O2, PH3 | H2O, NH3 | NaCl, MgF2 | Mg, Cu |
Sähkönjohtavuus | eriste | eriste | yleensä eriste, vesiliuoksena joskus johde* | kiinteänä eriste, sulatteena ja vesiliuoksena johde | johde |
Liukoisuus | liukenematon | liukenee poolittomiin aineisiin | liukenee veteen | liukenee yleensä veteen | liukenematon |
Kovuus kiinteänä | erittäin kova | helposti haihtuva | kova ja hauras | kova ja hauras | helposti muokattava |
*) Tällöin yhdiste on reagoinut veden kanssa, ja reaktiossa on muodostunut ioneja. | |||||
a) Mikä rakennemalli kuvassa on?
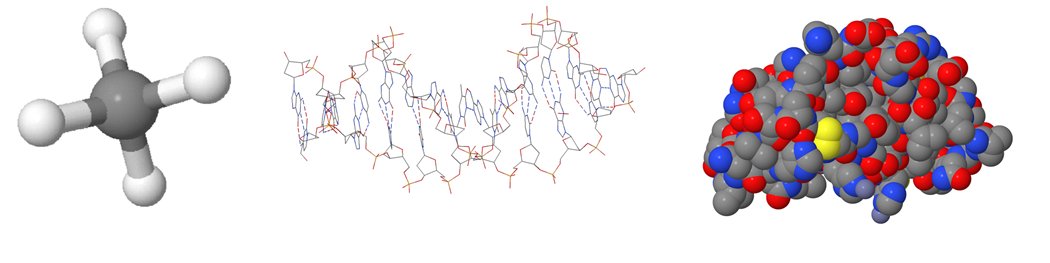
b) Viivakaavassa piirtämättä jätetään yleensä
- kaikki atomit.
- hiiliatomit.
- vetyatomit.
- sekä hiili- että vetyatomit.
c) Mikä seuraavista yhdisteistä vastaa suhdekaavaa (CH2O)x?
- C2H202
- C6H1206
- C4H602
- C4H402
d) Mitä oheisessa kuvassa tarkoitetaan punaisilla ja sinisillä alueilla?

- tapaa, jolla atomi sitoutuu toisiin atomeihin
- molekyylissä olevia atomeja
- elektronien jakautumista molekyylissä
- molekyylin väriä
e) Hila tarkoittaa
- säännöllistä rakennetta, jonka muodostavat atomit, ionit tai molekyylit.
- atomien välisiä sidoksia erilaisissa yhdisteissä.
- erilaisten yhdisteiden ja alkuaineiden fysikaalisia ominaisuuksia.
- aineen sulamispistettä, kovuutta ja kiehumispistettä.
Tiivistelmä
- Erilaisia 3D-malleja tarvitaan, koska jokainen mallityyppi sisältää erilaista tietoa. Tavoitteena on korostaa tarkastelun kohteena olevia yksityiskohtia.
- Rakennekaava ilmoittaa molekyylissä olevien atomien laadun ja määrän, atomeja yhdistävien sidosten laadun ja rakenteen geometrian.
- Tiivistetty rakennekaava ilmoittaa molekyylin rakenteen samalla tarkkuudella kuin rakennekaava, mutta jotkin sidosviivoista jätetään merkitsemättä.
- Suhdekaava ilmoittaa yhdisteen alkuaineiden lukumäärien suhteen. Esimerkiksi ruokasuolan suhdekaava on NaCl, mikä tarkoittaa, että natriumia ja vetyä on yhdisteessä suhteessa 1:1.
- Molekyylikaava ilmoittaa yhdisteen sisältämien alkuaineiden atomien lajit ja todelliset lukumäärät sekä mahdollisesti myös toiminnallisen ryhmän.
